Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.56 no.4 Maracaibo dic. 2015
Coccidioidomicosis: estado actual de la endemia en Venezuela.
Dilia Karina Martínez-Méndez1, Neomar Semprún-Hernández1 y Rosaura Coromoto Hernández-Valles2
1 Laboratorio de Inmunología, Facultad Experimental de Ciencias. Universidad del Zulia. Maracaibo, Venezuela.
2 Laboratorio de Micología. Programa de Medicina. Universidad Nacional Experimental Francisco de Miranda (UNEFM). Coro, Venezuela.
Autor de Correspondencia: Dilia Karina Martínez-Méndez. Facultad Experimental de Ciencias, Universidad del Zulia. Maracaibo, Venezuela. Correo Electrónico: dkmartinez.mw@gmail.com
Resumen. La coccidioidomicosis es una micosis sistémica endémica del continente americano, causada por un hongo dimórfico. La inhalación de artroconidios transportados por el viento permite la colonización del tejido pulmonar produciendo la micosis. El diagnóstico se realiza a través del estudio epidemiológico y micológico, complementándose con el histopatológico, inmunitario y molecular. En Venezuela ha sido reportada desde 1948 cuando el Dr. Humberto Campins describió el primer caso en Barquisimeto, estado Lara. Las micosis en Venezuela no son enfermedades de denuncia obligatoria por lo que existe un grave subregistro en las estadísticas anuales del país, sin embargo, los Grupos de Trabajo en Micología logran mantener la data de los casos. Los datos aportados acerca de las variables bioclimáticas y ambientales de las zonas endémicas pueden contribuir a la búsqueda del nicho ecológico del hongo, para así apoyar la vigilancia eco-epidemiológica de los casos clínicos y la pesquisa de casos subclínicos, fortaleciendo el sistema preventivo de salud y el manejo médico oportuno de la micosis.
Palabras clave: coccidioidomicosis; endemia; clínica; Venezuela.
Coccidioidomycosis: current status of the endemic in Venezuela.
Abstract. Coccidioidomycosis is a systemic fungal infection endemic in the Americas, caused by a dimorphic fungus. Inhalation of arthroconidia transported by wind colonize lung tissue causing mycosis. Diagnosis is made through epidemiological and mycological study, complemented by histopathological, molecular and immune response. In Venezuela it has been reported since 1948 when Dr. Humberto Campins described the first case in Barquisimeto, Lara state. The fungal diseases in Venezuela are not mandatory notification, so that t6here is a serious underreporting in the annual statistics of the country; however, the working groups in Mycology manage to keep the data of the cases. The information provided by bioclimatic and environmental variables in endemic areas can contribute to the pursuit of ecological niches of the fungus in order to strengthen eco-epidemiological surveillance of clinical cases and research subclinical cases, strengthening the preventive health system and appropriate medical management of mycosis.
Key words: coccidioidomycosis; endemic; symptoms; Venezuela.
Recibido: 11-06-2014 Aceptado: 15-01-15
INTRODUCCIÓN
La coccidioidomicosis (CDM), conocida también como enfermedad de California, fiebre del Valle de San Joaquín, enfermedad de Posadas – Wernicke y granuloma coccidial, es una micosis sistémica, endémica del continente americano, producida por un hongo dimórfico descrito por primera vez en Argentina en 1892 por Alejandro Posadas, estudiante de medicina que trabajaba en el laboratorio del Dr. Roberto Wernicke (1-3). Inicialmente confundido con un protozoo semejante a coccidia, se le denominó Coccidioides immitis (Coccidioides = semejante a coccidias e immitis = grave). En 1896, Rixford y Gilchrist lo reportan como un hongo contaminante del cultivo obtenido de la muestra de un inmigrante portugués (4). En 1900, Ophüls y Moffitt identifican y caracterizan al hongo como agente patógeno describiendo el dimorfismo parasitario y postulando la vía respiratoria como principal vía de colonización (3).
Biología y taxonomía
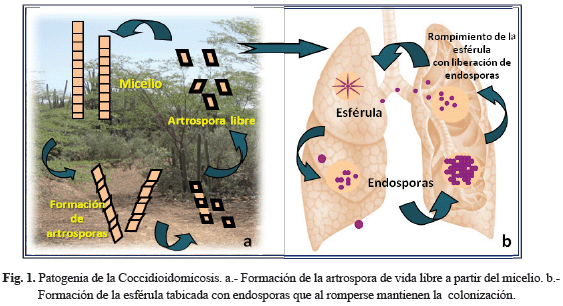
Coccidioides spp. son hongos dimorfos, poseen una fase saprobia constituida por micelio que se reproduce por pequeños artroconidios enterotálicos (2-5 μm) de fácil inhalación y una forma parasitaria, formada por esférulas que miden de 20 a 100 μm, segmentadas en cientos de endosporas (2, 3). Se han reportado formas atípicas de la fase parasitaria, tales como: a) hifas septadas, b) pequeñas cadenas de células redondas u ovaladas, c) endosporas agrupadas en forma de mórula o d) una mezcla de todas esas estructuras con o sin la presencia de esférulas endosporuladas (5, 6).
Hasta la fecha solo se ha descrito el estado anamorfo (7). En estudios realizados con la técnica de reconocimiento filogenético de especies y de concordancia genealógica (GCPSR, por sus siglas en inglés), evidenció divergencias entre aislados de Coccidioides spp. estableciéndose dos especies con escasas diferencias morfológicas, pero genéticamente distintas: C. immitis y C. posadasii (8, 9). Los estudios genéticos continúan realizándose con la finalidad de esclarecer si la divergencia tiene relación con la virulencia del hongo y la patogenia de la enfermedad (10-12).
La clasificación taxonómica de Coccidioides spp. ha sido actualizada quedando de la siguiente forma. Reino: Eumycota; Phylum: Dikaryomycota; Sub-phylum: Ascomycotina; Orden: Onygenales; Familia: Onygenaceae; Género: Coccidioides; Especies: immitis y posadasii (4, 8, 13).
Patogenia
La patogenia de la CDM se produce cuando un huésped susceptible inhala los diminutos artroconidios transportados por el viento hasta los pulmones, donde son capaces de evadir la destrucción por macrófagos alveolares, colonizando así el tejido pulmonar. Por efecto de la temperatura corporal el artoconidio cambia las características externas de su pared celular adelgazándola y formando pequeñas esférulas con septos internos que contienen endosporas. Una vez maduras, las esférulas se rompen liberando las endosporas cubiertas con el glicocáliz que le favorece la adherencia a los tejidos (Fig.1) (14). Este proceso dura hasta que la respuesta inmunitaria del individuo (o la intervención farmacológica) inhiba el crecimiento del hongo. Se ha reportado, en modelos animales, que la producción de citocinas proinflamatorias como IL-12 e INF-gamma se asocian con una respuesta celular (Th1) protectora frente al hongo, la cual pudiera también producirse en humanos (11,15) Anteriormente se había considerado que las respuestas inmunitarias de tipo Th2 no tenían efecto protector frente a la infección, pero los datos en el modelo murino sugieren que la actividad de las células B es muy importante en la inducción de la protección del huésped (16). En estudios realizados en ratones vacunados con una cepa viva atenuada de Coccidioides posadasii se reportó la inducción de una respuesta inmunitaria de tipo Th1, Th2 y Th17, siendo ésta última la más importante. Aquellos ratones carentes de un receptor para IL-17 eran más susceptibles a la exposición letal al hongo, aún estando vacunados; no se reportaron diferencias en los ratones deficientes de INF-gamma o IL-4. Se requieren estudios en humanos para clarificar la existencia de este tipo de respuesta (17, 18).
Una vez que se ha producido la infección, la afectación primaria generalmente es pulmonar, pero en casos de diseminación hematógena, se pueden aislar endosporas de Coccidioides spp. en otros órganos del cuerpo (19).
Clínica
Las formas de presentación clínica de la CDM se dividen en primaria y secundaria. La forma primaria generalmente es pulmonar, aunque se ha descrito primoinfección cutánea, representando el 1-2% de todos los casos (20-22). En el 60% de los individuos infectados, la primoinfección pulmonar es asintomática y sólo es diagnosticada al realizar estudios epidemiológicos con la prueba de Intradermoreacción (IDR) con coccidioidina. El 40% restante lo constituyen aquellos pacientes que desarrollan síntomas inespecíficos como tos, fiebre, dolor torácico, cefalea y anorexia que, aunado a la correcta evaluación clínica, epidemiológica y radiológica, permiten orientar el diagnóstico (3, 23-26). La radiografía de tórax (Rx) muestra infiltrados pulmonares únicos o múltiples, de localización parahiliar o basal, acompañados o no de adenopatías hiliares y pequeños derrames pleurales. También puede presentarse el complejo Fiebre del Valle, caracterizado por la presencia de reacciones de hipersensibilidad retardada tipo eritema nodoso o eritema multiforme, acompañado o no de artralgias y conjuntivitis; es más frecuente en mujeres caucásicas de mediana edad y, salvo escasas excepciones, denota buen pronóstico (10). La forma progresiva crónica sintomática sólo se desarrolla en un 5% de los casos (27). Cursa con neumonía crónica progresiva, tos, dolor torácico, fiebre, hemoptisis, disnea y anorexia. La radiografía muestra infiltrado pulmonar simple o múltiple, de localización parahiliar o basal (27).
La evolución a la forma diseminada guarda relación con las edades extremas de la vida, vivir o viajar frecuentemente a áreas endémicas (por el riesgo de exposición a elevadas concentraciones del inóculo inhalado), el embarazo, las enfermedades inmunosupresoras y factores genéticos (10, 24-26). Se presenta en el 1% de los pacientes sin embargo, estudios recientes indican un incremento en aproximadamente 4% relacionado con: a) inhalación de mayor inóculo, como se observa en los arqueólogos, constructores y personas expuestas a tormentas de arena, sobre todo influenciada por los cambios climáticos globales con períodos de máxima sequía (asociados al fenómeno del Niño); b) mayor frecuencia de enfermedades debilitantes del sistema inmunitario que alteran la respuesta inmunitaria celular (10, 26-29) y c) factores inmunogenéticos presentes en ciertos grupos étnicos, como los descendientes de Africanos y Filipinos (30). La CDM extrapulmonar generalmente ocurre por diseminación de una infección primaria pulmonar, manifestándose con frecuencia en los 2 primeros años después de la exposición inicial (31). La diseminación puede ocurrir por vía hematógena o linfática hacia piel, tejido celular subcutáneo, meninges, médula espinal y en raras ocasiones, a glándulas suprarrenales, hígado, cavidad peritoneal y riñones (25, 32 -34).
Diagnóstico
El diagnóstico de CDM se realiza a través del estudio epidemiológico y micológico (directo y cultivo), complementándose con el histopatológico, inmunitario y molecular. El interrogatorio epidemiológico debe documentar la procedencia o visitas a zonas endémicas. El estudio micológico directo se realiza al adicionar KOH al 10% a la muestra (esputo, lavado broncoalveolar, exudados de lesiones en mucosas, piel, entre otros) evidenciándose la presencia microscópica de esférulas, con paredes gruesas, refringentes y endosporas en su interior (2, 26). El cultivo en agar Sabouraud con cloranfenicol a temperatura ambiente (23-25ºC) favorece el crecimiento algodonoso, blanco grisáceo o amarillento característico de la fase micelial, con artroconidios intercalados con células fantasma (2, 3, 22). Al examen histopatológico teñido con ácido peryódico de Schiff (PAS), plata metenamina de Gomori (Grocott) o hematoxilina/eosina, se observan las esférulas. Los estudios inmunitarios evalúan la respuesta celular a través de la IDR con coccidioidina y la respuesta humoral mediante la detección de anticuerpos específicos por técnicas de Inmunodifusión Doble (IDD), Inmunosinéresis e Inmunoanálisis enzimático (ELISA) (2, 24, 35-37). Actualmente, las herramientas de biología molecular, en especial la reacción en cadena de la polimerasa en tiempo real (Real-time PCR), permiten la identificación genética de las especies de Coccidioides en muestras clínicas utilizando sondas específicas de especie (8,38 - 40).
Farmacología
Para el tratamiento de pacientes con CDM, se emplean triazoles, equinocandinas o anfotericina B, dependiendo del estado inmunitario del paciente y si la forma es pulmonar o diseminada (41,42). Escasos reportes han evidenciado la necesidad de emplear la cirugía en casos extremos, sobre todo cuando hay coccidioidomas en el sistema nervioso central (43). En 2011, Cordeiro y col. (44) propusieron que el uso sinérgico del cotrimoxazol mejora la sensibilidad invitro de aislados de C. posadasii a los antifúngicos, sin embargo el estudio fue realizado utilizando la fase sapróbia del hongo y el dimorfismo representa un aspecto que debe ser evaluado para poder establecer la viabilidad exacta de esta alternativa terapéutica.
ECOLOGÍA DE COCCIDIOIDES SPP. EN AMERICA
En América, las zonas en donde se ha aislado Coccidioides spp., tanto del suelo como de muestras de pacientes están ampliamente distribuidas, abarcando desde el estado de California, Arizona, Nevada, Texas, Nuevo México y Utah en USA; el desierto de Sonora, Coahuila y Baja California en México, pasando por Honduras, Colombia, Bolivia, Venezuela y Paraguay hasta el desierto argentino (45-49).
Las condiciones eco-ambientales constituyen uno de los principales factores relacionados con la aparición de la CDM (50, 51).Varios autores han establecido la estrecha relación que existe entre la mayor incidencia de CDM y los eventos climáticos y meteorológicos, en donde los meses con mayor número de pacientes corresponden a los meses más secos del año, precedidos de lluvias estacionales (52-57).
La importancia epidemiológica que la CDM representa en el sur de Estados Unidos y norte de México ha sido ampliamente estudiada, estableciéndose la relación entre las características ecológicas y el reporte de casos, pero a pesar de que éstos se han incrementado en los últimos años, son pocos los aislados obtenidos del ambiente. Esta baja correlación entre los datos epidemiológicos y ambientales pudiera deberse a una falta de caracterización del nicho ecológico de Coccidioidess spp. que incluya un amplio rango de condiciones ambientales favorables a la existencia del hongo. En 2007, Baptista-Rosas y col. (48) propusieron un modelo informático denominado Genetic Algorithm for Rule Set Production (GARP), empleando un software interactivo, fundamentado en variables bioclimáticas y ambientales de los sitios donde se ha logrado aislar Coccidioides spp. Éste programa sugiere los mejores lugares para la recolección de las muestras mediante la evaluación del índice de pluviosidad, cantidad de polvo y dispersión de artrosporas según la estación climática del año (verano, otoño, invierno y primavera). Estos datos y los aportados por otros investigadores, han permitido establecer un modelo de distribución geográfica de Coccidioides spp. en el sur de Estados Unidos de Norteamérica (USA) y norte de México, estableciendo los factores climáticos que favorecen la aparición de brotes y la elaboración de modelos predictivos para su prevención (56,58,59).
El grupo de Egeberg en 1964 (58), estudiaron durante 8 años, 6 acres (3,23 hectáreas) de tierra en un área endémica del estado de California (USA) y concluyeron que la mayor tasa de recuperación del Coccidioides spp. se produjo durante la primavera de los años en donde la concentración de sales es mayor, facilitando el crecimiento del mismo por la inhibición de saprobios no tolerantes a las altas concentraciones de sal. Sin embargo, el porcentaje de recuperación de Coccidioides spp. a partir de muestras de tierra, de hasta 20 cm de profundidad, es apenas de 1 a 2% (9). En un estudio realizado en Tijuana, México se reportó el aislamiento a partir del aire, de un hongo de aspecto blanquecino, algodonoso y que microscópicamente presentaba hifas septadas y artroconidios típicos de C. immitis, sin embargo, los autores no refieren haber realizado estudios en animales de experimentación que permitan evaluar la formación de esférulas (45).
ESTADO ACTUAL DE LA ENDEMIA EN VENEZUELA
Ecología de Coccidioides spp. En Venezuela
Las áreas endémicas de Venezuela son zonas semidesérticas caracterizadas por climas áridos, secos, de veranos muy calurosos e inviernos suaves, baja altitud, vegetación xerófita y escasa precipitación anual, suelos arenosos con elevadas concentraciones de sales (boro y sulfato de calcio) y pH alcalino, favorables para el crecimiento de Coccidioides spp. (2, 60, 61). Las zonas áridas reciben menos de 800 mm anuales de lluvia que se pierde por escurrimiento y evaporación, haciendo que la capa superficial del suelo se vuelva polvo, de fácil desplazamiento por las corrientes de aire (46, 47). Coccidiodes spp. sobrevive en estos suelos a altas temperaturas, creciendo en forma de micelio que se fragmenta con facilidad, dispersándose los artroconidios a varios kilómetros de distancia como consecuencia de los vientos o del movimiento de la tierra por acción del hombre (construcción, arqueología, deforestación) (2, 48-50, 62).
Una investigación realizada en la Península de Paraguaná del estado Falcón, de donde proceden la mayoría de los casos registrados de CDM en Venezuela, reportó que las características ecoambientales y químicas del suelo favorecen la presencia del hongo. Los autores describen un aislado obtenido del suelo sugestivo de Coccidioides spp., pero que no mostró la formación de esférulas al ser inoculado en animales de experimentación, sugiriendo que pudiera tratarse de una especie distinta a Coccidioides spp. o una variante poco virulenta del hongo (38, 61).
Epidemiología de Coccidioides spp.
Las micosis en Venezuela no son enfermedades de denuncia obligatoria, por lo que existe un grave subregistro en las estadísticas anuales. Sin embargo, gracias al esfuerzo de los Grupos de Trabajo en Micología formados desde 1984 por un equipo multidisciplinario de profesionales dedicados al estudio, seguimiento y levantamiento estadístico de las micosis en el país a través del boletín informativo Las micosis en Venezuela, existen algunos datos epidemiológicos.
En Venezuela, la CDM ha sido reportada desde 1948 cuando el Dr. Humberto Campins reportó el primer caso en Barquisimeto, estado Lara. Durante 2 décadas, describió la enfermedad en pacientes provenientes de los estados Zulia, Falcón y Lara. Esta distribución se ha mantenido hasta la actualidad, adicionándose pocos casos provenientes del estado Aragua y del Distrito Federal (60, 63-71). En 1953, Pollak, en un ensayo epidemiológico para Histoplasmosis que incluía la aplicación de coccidioidina (antígeno de la fase micelial del Coccidioides spp.), mediante la prueba de IDR, reportó el caso de una mujer natural y procedente de Coro, estado Falcón, que resultó positiva a ésta prueba y negativa a la histoplasmina (64). Posteriormente, Zirit y col. (67) en un estudio epidemiológico de CDM con la prueba de IDR realizado a 300 individuos residentes en la ciudad de Coro, reportó que 34 personas presentaron reacción positiva (11,34%) y ellas provenían y/o se desplazaban con regularidad a las zonas áridas del estado Falcón, confirmando lo propuesto por Campins y col. (60), acerca de que la zona árida de ese estado es área endémica de CDM.
En 1987, un estudio de las mismas características realizado en la población de Pueblo Nuevo de Paraguaná reportó 16% de reactividad a la IDR con coccidioidina (65). En 2010, en esa misma población, se realizó una evaluación inmuno-epidemiológica que abarcó 206 habitantes, a quienes se les aplicó la prueba de IDR con coccidioidina y confirmación serológica a través de la prueba de inmunodifusión doble. La reactividad encontrada a la IDR fue del 26%, pero ningún individuo presentó serología positiva a Coccidioides spp. Este resultado, plantea que el número de personas de esa comunidad expuestas al agente es mayor que el observado en estudios previos, sin embargo no desarrollan la enfermedad, por alguna razón aún desconocida para los investigadores. Es probable que factores inmunogenéticos asociados a una adecuada respuesta inmunitaria frente al hongo estén presentes en la población o que en esa zona exista una variante poco virulenta del hongo (70).
En Venezuela hasta el primer trimestre del 2014, el número de casos confirmados de CDM desde 1948, publicados en estudios epidemiológicos, reportados por los Grupos de Trabajo en Micología y colectados de los pocos laboratorios que realizan estudios serológicos en CDM, es de 114, en su mayoría provenientes de los estados Zulia, Lara y Falcón (49, 60, 63-71). Esto coincide con lo propuesto por Campins y Borelli, quienes circunscriben la endemia a la zona árida de esos estados, estableciendo como principal factor de riesgo el contacto con tierra seca, aerolizable, de fácil desplazamiento por los vientos, que puede afectar a las personas que trabajan, habitan o visitan esas zonas secas (49, 60).
Se considera importante continuar los estudios inmuno-epidemiológicos y eco-ambientales de CDM en diferentes comunidades de la zona endémica y en distintas épocas del año, a fin de establecer los factores climáticos que pudieran favorecer la presencia del hongo y por ende, la aparición de casos clínicos. En individuos habitantes o visitantes de la zona endémica que desarrollen cuadros infecciosos de evolución tórpida, debe descartarse la CDM como posible enfermedad primaria (68, 70, 72).
CONCLUSIÓN
El conocimiento de la procedencia de los casos de CDM a nivel mundial y nacional, ha permitido delimitar geográficamente las zonas endémicas. Los datos aportados acerca de las variables bioclimáticas y ambientales de los sitios donde se ha logrado aislar Coccidioides spp. pueden contribuir a la búsqueda del nicho ecológico del hongo en las zonas endémicas para así apoyar la vigilancia eco-epidemiológica de los casos clínicos y pesquisa de casos subclínicos, fortaleciendo el sistema preventivo de salud y el manejo médico de la CDM. Los casos de CDM procedentes de zonas endémicas plantean la necesidad de descartar esta patología en todo paciente con síntomas respiratorios y/o lesiones ulcerosas en la piel que vivan en la zona o que informen haberse desplazado hacia ella.
REFERENCIAS
1. Posadas A. Un nuevo caso de micosis fungoide con Sorospermias. An Cir Med Argentina. 1892;15:585-597. [ Links ]
2. Albornoz MC. Coccidioidomicosis. En: Bastardo de Albornoz MC, Ed. Temas de Micología Médica. 1996;221-234. [ Links ]
3. Arenas, R. Coccidioidomicosis. En: Roberto Arenas. Microbiología Médica Ilustrada. 4ª. edición. 2011;157-165. [ Links ]
4. Rixford E, Gilchrist TC. Two cases of protozoan (coccidoidal) infection of the skin and other organs. Jhon´s Hopkins Hosp Rep. 1896;1:209-268. [ Links ]
5. Muñoz B, Castañón LR, Calderón I, Vázquez ME, Manjares ME. Parasitic mycelial forms of Coccidioides species in Mexican patients. J Clin Microbial 2004;42(3):1247-1249. [ Links ]
6. Muñoz-Hernández B, Palma-Cortés G, Cabello-Gutiérrez C, Martínez-Rivera MA. Parasitic polymorphism of Coccidioides spp. BMC Infect Dis 2014;14(1):213-222. [ Links ]
7. Koufopanou V, Burt A, Szaro T, Taylor J. Gene genealogies, cryptic species, and molecular evolution in the human pathogen Coccidioides immitis and relatives (Ascomycota, Onygenales). Mol Bio Evol 2001;18(7):1246-1258. [ Links ]
8. Fisher MC, Koenig GL, White TJ, Taylor JW. Molecular and phenotyphic description of Coccidioides posadasii sp. Nov., previously recognized as the non-Californian population of Coccidioides immitis. Mycologia 2002;94(1):73-84. [ Links ]
9. Cordeiro RA, Brilhante RSN, Rocha MFG, Fechine MAB, Camara LMC, Camargo ZP, Sidrim JJC. Phenotypic characterization and ecological features of Coccidioides spp. from Northeast Brazil. Med Mycol 2006;44:631-639. [ Links ]
10. Cox R, Mitchell M. Coccidioidomycosis: host response and vaccine development. Clin Microbiol Rew 2004;17(4):804-839. [ Links ]
11. Xue J, Hung Ch-Yu, Yu J-J, Cole G. Immune response of vaccinated an non-vaccinated mice to Coccidioides posadasii infection. Vaccine 2005;23:3535-3544. [ Links ]
12. Sano A, Miyaji M, Kamei K, Mikami Y, Nishimura K. Reexamination of Coccidioides spp. reserved in the Research Center for Pathogenic Fungi and Microbial Toxicoses, Chiba University, based on a multiple gene analysis. Jpn J Med Mycol 2006;47(2):113-117. [ Links ]
13. Abuodeh R, Galgiani J, Scalarone GM. Molecular approaches to the study of Coccidioides immitis. Int J Med Microbiol 2002;292(5-6):373-380. [ Links ]
14. Galgiani J. Coccidioidomicosis. West J Med 1993;159:153-171. [ Links ]
15. Ampel NM. The complex immunology of human coccidioidomycosis. Ann NY Acad Sci 2007;1111:245-258. [ Links ]
16. Magee DM, Friedberg RL, Woitaske MD, Johnston SA, Cox RA. Role of B cells in vaccine-induced immunity against coccidioidomycosis. Infect Immun 2005;73:7011-7013. [ Links ]
17. Hung CY, Gonzalez A, Wuthrich M, Klein BS, Cole GT. Vaccine immunity to coccidioidomycosis occurs by early activation of three signal pathways of T helper cell response (Th1, Th2, and Th17). Infect Immun 2001;79:4511-4522. [ Links ]
18. Wüthrich M, Gern B, Hung CY, Ersland K, Rocco N, Pick-Jacobs J, Galles K, Filutowicz H, Warner T, Evans M, Cole G, Klein B. Vaccine-induced protection against 3 systemic mycoses endemic to North America requires Th17 cells in mice. J Clin Invest 2011;121:554–568. [ Links ]
19. Chang A1, Tung RC, McGillis TS, Bergfeld WF, Taylor JS. Primary cutaneous coccidioidomycosis. J Am Acad Dermatol 2003;49:944-949. [ Links ]
20. Crum N. Disseminated coccidiodomycosis with cutaneous lesions clinically mimicking mycosis fungoides. Int J Dermatol 2005;44:958-960. [ Links ]
21. Jaramillo-Moreno G, Velazquez-Arenas L, Méndez-Olvera N, Ocampo-Candiani J. Primary cutaneous coccidioidomycosis: case report and review of the literature. Int J Dermatol 2006;45:121-123. [ Links ]
22. Arango M, Castañeda E. Coccidioidomicosis. En Myrtha Arango y Elizabeth Castañeda: Micosis Humanas, Procedimientos Diagnósticos, Exámenes Directos. Corporación para Investigaciones Biológicas, 2ª edición. 2003:89-92. [ Links ]
23. Ampel N. Coccidioidomycosis: A review of recent advances. Clin Chest Med 2009;30:241–325. [ Links ]
24. Blair JE, Currier JT. Significance of isolated positive IGM serologic results by enzyme immunoassay for coccidioidomycosis. Mycopathologia 2008; 166(2):77-82. [ Links ]
25. Tang CG, Nuyen BA, Puligandla B, Rasgon B. The coccidioidomycosis conundrum: a rare parotid mass. Perm J 2014;18(2):86-88. [ Links ]
26. Cabello H, Labarca G, Fernández-Bussy S, Cabello F, Pires Y, Soto R, Thompson L. Falla de tratamiento en neumonía adquirida en la comunidad: coccidioidomicosis en un viajero. Rev Chilena Infectol 2013;30(6):669-672. [ Links ]
27. Ampel N. Coccidioidomycosis: a review of recent advances. Clin Chest Med 2009;30:241-251. [ Links ]
28. Desai SA, Minai OA, Gordon SM, O´Neil B, Widemann HP, Arroliga AC. Coccidioidomycosis in non-endemic areas: a case series. Resp Med 2001;95:305-309. [ Links ]
29. Petersen L, Marshall S, Barton-Dickson B, Hajjeh R, Lindsley M, Warnock D, Panackal A, Shaffer J, Haddad M, Fisher F, Dennis D, Morgan J. Coccidioidomycosis among workers at an archeological site, northeastern Utah. Emerg Inf Dis 2004;10(4):637-642. [ Links ]
30. Louie L, Ng S, Hajjeh R, Johnson R, Vugia D, Werner SB, Talbot R, Klitz W. Influence of host genetics on the severity of coccidioidomycosis. Emerg Infect Dis 1999;5(5):672–680. [ Links ]
31. Thompson GR 3rd. Pulmonary coccidioidomycosis. Semin Respir Crit Care Med 2011;32(6):754-763. [ Links ]
32. Crum NF, Lederman ER, Stafford CM, Parrish JS, Wallace MR. Coccidioidomycosis: a descriptive survey of a reemerging disease. Clinical characteristics and current controversies. Medicine 2004;83(3):149-175. [ Links ]
33. Papadopoulos KI, Castor B, Klingspor L, Dejmek A, Lorén I, Bramnert M. Bilateral isolated adrenal coccidioidomycosis. J Intern Med 1996;239(3):275-278. [ Links ]
34. Phillips P, Ford B. Peritoneal coccidioidomycosis: case report and review. Clin Infect Dis 2000;30(6):971-976. [ Links ]
35. Brown J, Benedict K, Park BJ, Thompson GR 3rd. Coccidioidomycosis: epidemiology. Clin Epidemiol 2013;5:185-197. [ Links ]
36. Ouchterlony O. Handbook of immunodiffusion and immunoelectrophoresis. Ann Arbor Publishers, Inc. Ann Arbor. 1968. [ Links ]
37. Humbría García L, Hernández Valles R, Pérez Blanco M, García Hernández L, Mendoza M, Zambrano E. Evaluación del inmunoanálisis enzimático en el diagnóstico y seguimiento de pacientes con coccidioidomicosis. Rev Soc Ven Microbiol 2011;31(1): 42-47. [ Links ]
38. Barbosa Cavalcanti S, Martinelli Vidal M, Teixeira De Sousa M, Barbaro Del Negro G. Viability and molecular authentication of Coccidioidesspp. isolatesfrom the Instituto de Medicina Tropical de São Paulo culture collection, brazil. Rev Inst Med Trop Sao Paulo 2013; 55(1):7-11. [ Links ]
39. Bialek R, González G, Begerow D, Zelck U. Coccidioidomycosis: advances in molecular diagnosis. FEMS Inmunol Med Microbiol 2005;45:355-360. [ Links ]
40. Binnicker MJ, Buckwalter SP, Eisberner JJ, Stewart RA, McCullough AE, Wohlfiel SL, Wengenack NL. Detection of Coccidioides species in clinical specimens by real-time PCR. J Clin Microbiol 2007;45:173-178. [ Links ]
41. Galgiani JN, Ampel NM, Catanzaro A, Johnson RH, Stevens DA, Williams PL. Practice guideline for the treatment of coccidioidomycosis. Infectious Diseases Society of America. Clin Infect Dis 2000;30(4):658-661. [ Links ]
42. Park DW, Sohn JW, Cheong HJ, Kim WJ, Kim MJ, Kim JH, Shin C. Combination therapy of disseminated coccidioidomycosis with caspofungin and fluconazole. BMC Infect Dis 2006;6:26-28. [ Links ]
43. Baddley JW, Cobbs C, Pappas PG. Surgical treatment of multiple skull abscesses associated with Coccidioidomycosis. Mycoses 2004;47(1-2):69-71. [ Links ]
44. Cordeiro R de A, Astete-Medrano DJ, Marques FJ, Andrade HT, Perdigão Neto LV, Tavares JL, de Lima RA, Patoilo KK, Monteiro AJ, Brilhante RS, Rocha MF, de Camargo ZP, Sidrim JJ. Cotrimoxazole enhances the in vitro susceptibility of Coccidioides posadasii to antifungals. Mem Inst Oswaldo Cruz 2011;106(8):1045-1948. [ Links ]
45. Laniado R, Cárdenas R, Álvarez M. Tijuana: zona endémica de infección por Coccidioidesimmitis. Salud Pública México 1991;33:235-239. [ Links ]
46. Mondragón-González R, Méndez-Tovar LJ, Bernal-Vázquez E, Hernández-Hernández F, López-Martínez R, Manzano-Gayosso P, Rios Rosas C, Contreras-Pérez C, Anides-Fonseca AE. Detección de infección por Coccidioides immitis en zonas del estado de Coahuila, México. Rev Arg Microbiol 2005;31:135-138. [ Links ]
47. Hector RF, Laniado-Laborin R. Coccidioidmycosis – A fungal disease of the Américas. PLoSMed 2005;2(1):e2. [ Links ]
48. Baptista-Rosas R, Hinojosa A, Riquelme M. Ecological niche modeling of Coccidioidesspp. In Western North American Deserts. Ann NY Acad Sci 2007;1111:35-46. [ Links ]
49. Borelli D, Pérez M, Molina T. Coccidioidomicosis: un caso más en el bosque muy seco tropical. Derm Venez 1991;29(4):119-123. [ Links ]
50. Comrie AC. Climate factors influencing coccidioidomycosis seasonality an outbreaks. Environ Heatlh Perspect 2005;113:688-692. [ Links ]
51. Baptista-Rosas R. Assessing the impact of global climate change on the borderlands: the case of valley fever. Border Climate Summary 2009;2:1-10. [ Links ]
52. Padua GA, Martínez-Ordaz VA, Velazco-Rodríguez VA, Lazo-Sáenz JG, Cícero R. Prevalence of skin reactivity to coccidioidin and associated risk in subjects living in a northern city in Mexico. Arch Med Res 1999;30:388-392. [ Links ]
53. Kolivras K, Comrie A. Modeling valley fever (coccidioidomycosis) incidence on the basis of climate conditions. Int J Biometereol 2003;47:87-101. [ Links ]
54. Kolivras K, Johnson P, Comrie A, Yool S. Enviromental variability and coccidioidomycosis (Valley Fever). Aerobiología 2001;17:31-42. [ Links ]
55. Zender C, Talamantes J. Climate control in valley fever in Kern County California. Int J Biometeorol 2006;50:174-182. [ Links ]
56. Baptista-Rosas R, Arellano E, Hinojosa A, Riquelme M. Bioclimatología de la coccidioidomicosis en Baja California, México. Invest Geograf 2010;71:21-30. [ Links ]
57. Benedict K, Park BJ. Invasive fungal infections after natural disasters. Emerg Infect Dis 2014;20(3):349-355. [ Links ]
58. Egeberg R, Elconin A, Egerberg M. Effect of salinity and temperature on Coccidioidesimmitis and three antagonistic soil saprophytes. J Bacteriol. 1964;88:473-476. [ Links ]
59. Elconin A, Egeberg R, Egerberg M. Significance of soil salinity on the ecology of Coccidioides immitis. J Bacteriol 1964; 87:500-503. [ Links ]
60. Campins H. Coccidioidomycosis en Venezuela. En: Libero Ajello. Coccidioidomycosis. The University of Arizona Press. 1967:279-285. [ Links ]
61. Martínez Méndez D, Hernández Valles R. Ecología de la coccidioidomicosis en el municipio Falcón de la Península de Paraguaná, estado Falcón, Venezuela. Rev Soc Ven Microbiol 2010; 30:97-101. [ Links ]
62. Wilken JA, Marquez P, Terashita D, McNary J, Windham G, Materna B. Coccidioidomycosis among cast and crew members at an outdoor television filming event-California, 2012. MMWR Morb Mortal Wkly Rep 2014;63(15):321-324. [ Links ]
63. Grupos de Trabajo en Micología. Casuística de las Micosis profundas, Compilación 24 años de historia 1984-2008. Boletín Informativo Las Micosis en Venezuela. 2009;42:10. [ Links ]
64. Pollack L. Histoplasmosis en Venezuela. Ensayo Epidemiológico. Act Med Venez. 1953;1:150-152. [ Links ]
65. Quintero MA, Padilla R, Laguna X, Sanchez-Mirt A, Mirt JA. Estudio inmuno-epidemiológico y radiológico de la coccidioidomicosis en los habitantes de Pueblo Nuevo (Paraguaná, edo. Falcón). Boletín Informativo Las Micosis en Venezuela. 1987;(9):11-12. [ Links ]
66. Archivos del Laboratorio de Micología. Centro de Investigaciones Biomédicas, Universidad Nacional Experimental Francisco de Miranda. Coro, estado Falcón, Venezuela. Casuística 1985-2008. [ Links ]
67. Zirit R, Graterol C, Borelli D. Coccidioidomisosis. Comprobación de la endemia en el Estado Falcón, Venezuela y relato de un caso. Dermatol venez 1959;1:308-324. [ Links ]
68. Mirt JA, Sánchez-Mirt A. Coccidioidomicosis: Siete Casos en el estado Falcón, Venezuela. Inves clin. 1988;29:71-78. [ Links ]
69. Lecuna V, Padula C. Encuesta micológica piloto en la Llanura árida del norte del estado Falcón (Venezuela). Dermatol Venez. 1963;1:78-85. [ Links ]
70. Martínez Méndez D. Coccidioidomicosis: Prevalencia y Ecoepidemiología. Municipio Falcón, Península de Paraguaná, Estado Falcón, Venezuela. [Tesis Maestría]. Univ. Nacional Experimental Francisco de Miranda. Coro. 2010. [ Links ]
71. Martínez Méndez D, Hernández Valles R, Alvarado P, Mendoza M. Las micosis en Venezuela: casuística de los Grupos de Trabajo en Micología (1984-2010). Rev Iberoam Micol. 2013;30(1):39–46. [ Links ]
72. Blair JE, Mendoza N, Force S, Chang YH, Grys TE. Clinical specificity of the enzyme immunoassay test for coccidioidomycosis varies according to the reason for its performance. Clin Vaccine Immunol. 2013;20:95-98. [ Links ]











 uBio
uBio