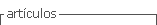Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.31 no.3 Caracas set. 2012
Utilidad del albendazol/quinfamida en el tratamiento de la fase intestinal de la infección por Trichinella Spiralis en modelo Murino
Utility of albendazole/quinfamide in the treatment of intestinal phase of infection in murine model Trichinella Spiralis
*M en BE Mayra Judith García Robles, **M en BE Gabriela Reveles Hernández, ***M. en C. José Jesús Muñoz Escobedo, **Dra en C. María Alejandra Moreno García.
* Alumna de la Maestría en Biología Experimental. UABE.UAZ.
**Docente Investigador Unidad Académica de Biología Experimental, Universidad Autónoma de Zacatecas,
***Docente de la Unidad Académica de Odontología UAZ. Departamento de biología Celular y Microbiología de la Unidad Académica de Biología Experimental, Universidad Autónoma de Zacatecas.
Correspondencia: amoreno_29@hotmail.com
Resumen
La triquinelosis es una enfermedad parasitaria ocasionada por el nematodo Trichinella spiralis. Actualmente el tratamiento utilizado para la triquinelosis es la administración de albendazol o mebendazol. Estos medicamentos son efectivos contra el parásito, solo si se administran por periodos prolongados; sin embargo existe el inconveniente de que pueden causar efectos adversos en el hospedero. El objetivo de este trabajo fue evaluar el efecto terapéutico del medicamento OXAL® (albendazol/quinfamida) contra la infección por T. spiralis en modelo murino, durante la fase intestinal de la infección (1 y 7 días) por un periodo de 3 días. Los resultados obtenidos mostraron que la administración de OXAL® durante 3 días, tuvo eficacia terapéutica durante la fase intestinal, ya que no se obtuvo carga parasitaria en el grupo con 1 día de infección, y la obtenida en el grupo con 7 días de infección tuvo una disminución significativa respecto al control, p < 0.05.
Palabras clave: Trichinella spiralis, fase intestinal, tratamiento
Summary
Trichinellosis is a parasitic disease caused by the nematode Trichinella spiralis. Currently the treatment for Trichinellosis includes the administration of albendazole or mebendazole. These drugs are effective against the parasite, only if administered for prolonged periods; however there is a drawback that can cause adverse effects on the host. The aim of this study was to evaluate the therapeutic efficacy OXAL® (albendazole /quinfamide) against infection by T. spiralis in mice during the intestinal phase of the infection (1, and 7 days) for a period of 3 days. The results showed that administration of OXAL® for 3 days, had effective therapy for intestinal phase, since there was no parasitic load in the group with 1 day of infection, and the obtained in the group with 7 days of infection showed a significant decrease with regard to control, p <0.05.
Key words: Trichinella spiralis, intestinal phase, treatment
Recibido: 28/10/2011 Aceptado: 28/01/2012
Introducción
La triquinelosis es una infección transmitida por el nematodo Trichinella spiralis, y ha sido una enfermedad importante desde la antigüedad, aunque frecuentemente no es reconocida, sin embargo continua siendo una preocupación de salud pública a nivel mundial. Se estima que aproximadamente diez millones de personas alrededor del mundo podrían estar infectadas1. La infección comienza al ingerir carne cruda o insuficientemente cocida (principalmente carne de puerco y productos realizados con ella) de animales infectados que contienen larvas infectantes (LI) en su fase muscular, las LI ingeridas migran y son encapsuladas en el músculo. La enfermedad clínica en el hombre es altamente variable y puede presentarse desde una infección asintomática, hasta una fulminante enfermedad fatal2. Factores como la edad, sexo, estado nutricional, así como el número de larvas ingeridas viables son relacionados con la severidad de la infección1.
El diagnóstico de la infección se basa la detección directa o indirecta del parásito en el hospedero. Las técnicas directas incluyen la triquinoscopia, análisis histológico de tejido muscular y digestión artificial, mientras que la técnicas indirectas más utilizadas para la detección de anticuerpos (Ac) específicos de T. spiralis son: Dot-ELISA Western blot e inmunofluorescencia indirecta1. En México, el albendazol y mebendazol (benzimidazoles) son utilizados como tratamiento de elección para la infección por T. spiralis. Aunque parte del efecto de los benzimidazoles es alterar diversas reacciones bioquímicas del gusano, incluida la captación de glucosa, su acción principal se ejerce mediante una interacción con la β-tubulina, inhibiendo de ese modo la polimerización necesaria para la formación de los microtúbulos, los cuales además de formar el citoesqueleto participan en diversas funciones celulares, particularmente en la división celular, el transporte de nutrientes y la excreción de desechos metabólicos; de tal manera que algunas funciones del mantenimiento de la forma celular, división celular y transporte intracelular son alteradas, dando como resultado final la inmovilización y muerte del parásito[3]; sin embargo para tener el efecto terapéutico esperado, su administración debe ser por periodos prolongados y ello puede ser causa de efectos colaterales.
La Food and Drug Administration (FDA), ha establecido cinco categorías que indican el nivel de riesgo que poseen los medicamentos para los fetos. El albendazol y el mebendazol se encuentran en la categoría C, ya que se ha demostrado evidencia de efectos embriotóxicos y teratogénicos en animales experimentales4. Un estudio realizado en ratas preñadas demostró que la exposición prenatal al albendazol entre los días 9 y 11 es causa de malformaciones, retardo de desarrollo fetal y alteraciones estructurales hepáticas5. También se ha comprobado que los fetos muestran un retraso en crecimiento, marcado por desarrollo anormal y/o nulo en órganos vitales, tanto en cavidad torácica como en cavidad abdominal6. Asimismo, existe el reporte de un feto con efectos teratogénicos causados por la administración de mebendazol por 10 días, a una mujer embarazada con diagnóstico de triquinelosis.
Existen antiparasitarios que combinan dos medicamentos, tal es el caso de OXAL®, cuya formulación contiene albendazol, un antihelmíntico, y la quinfamida, un amebicida luminal7, que actúa inhibiendo la disponibilidad del hierro e interfiriendo con el crecimiento y motilidad de la amiba8,9. La asociación de fármacos ocurre frecuentemente, ya que se pueden obtener sinergias funcionales con aplicaciones terapéuticas beneficiosas, aunque también puede tener consecuencias tóxicas. Las interacciones farmacodinámicas sinérgicas frecuentemente se utilizan en el aparato circulatorio, la terapéutica anticoagulante, antineoplásica y en la terapéutica antiinfecciosa, entre otros10. El OXAL® es considerado como un antiparasitario capaz de eliminar amibas, nematodos y cestodos; su dosificación se administra solo por un día, y si es necesario por tres días más7. Puesto que el efecto final de los dos medicamentos es inmovilizar a los parásitos, es posible que la asociación de albendazol y quinfamida, resulte en una sinergia que aumentará la inmovilización y posterior muerte del parásito
Objetivo
Evaluar la eficacia terapéutica de la asociación del albendazol/quinfamida, como tratamiento contra la infección por Trichinella spiralis durante fase intestinal en modelo murino.
Metodología
Se utilizaron 2 grupos experimentales (ATX, BTX). Cada grupo estuvo formado por 10 ratas hembras Long Evans de 2.5 meses de edad. Los grupos tuvieron 1 y 7 días de evolución de infección por T. spiralis. A los grupos experimentales se les administró OXAL® (albendazol/quinfamida) por vía oral a una dosis de 15 mg/kg de peso durante 3 días y se sacrificaron 15 días después del tratamiento (dtx) de esta manera se evaluó si las larvas de T. spiralis completaron su ciclo biológico. De cada rata se obtuvo una muestra de sangre antes de la infección y previo al sacrificio. Se recolectaron muestras de tejidos (diafragma, lengua, masetero y pierna). Con las muestras de sangre y tejido obtenidas se realizaron las técnicas directas e indirectas utilizadas en el diagnóstico de T. spiralis. Se utilizaron 2 grupos control (AC y BC). Cada grupo estuvo formado por 5 ratas hembras Long Evans de 2.5 meses de edad y tuvieron el tiempo total de evolución de infección por T. spiralis que el grupo experimental correspondiente, no se les administró el medicamento y se les realizaron las técnicas directas e indirectas utilizadas en el diagnóstico de T. spiralis. OXAL® es un medicamento que combina el albendazol, un antihelmíntico de amplio espectro, con la quinfamida, un amebicida luminal. Por lo que es importante evaluar su acción de manera independiente. Para ello se utilizaron 4 grupos adicionales ATXALB, ATXQ, BTXALB y BTXQ, con 1 y 7 días de evolución de infección por T. spiralis respectivamente. A los grupos ATXALB y BTXALB se les administró albendazol a una dosis de 15 mg/kg de peso, mientras que a los grupos ATXQ y BTXQ se les administró quinfamida a una dosis de 2.5 mg/kg de peso. A estos grupos solo se les realizaron las técnicas directas. Los grupos experimentales y los grupos control fueron infectados con 500 LI de T. spiralis. Para ello las ratas se separaron en cajas individuales y se le dio de comer una porción de tejido infectada (previo al conteo de larvas por gramo de carne).
Compresión en placa
Se obtuvieron muestras de tejido de las ratas sacrificadas (lengua, masetero, pierna y diafragma) de aproximadamente 0.5 g. Cada muestra se colocó entre dos laminillas de vidrio y se comprimió, ocupando un área aproximada de 1 cm x 0.5 cm, se observó al microscopio con el objetivo de 10x y 20x, para verificar la presencia o ausencia de células nodrizas de T. spiralis11.
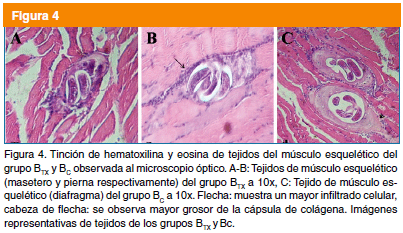
Tinción de Hematoxilina y Eosina
Las muestras de tejido se fijaron en formol al 10%. La tinción se realizó de acuerdo al Manual of Histologic and Special Staining Technics12 y se observaron al microscopio con objetivo de 10x, 20x y 40x. Esta técnica permite observar la integridad de la célula nodriza y el infiltrado celular presente.
Digestión artificial
El tejido obtenido se trituró hasta obtener un homogenizado, del cual se colocaron 30 g en un tamiz de tul con forma de saco dentro de un embudo de separación, ahí se suspendió en una solución digestora (3.5 g de pepsina, 7.5 ml de HCl, aforados en 1000 ml de agua destilada) y se incubó a 37 ºC por 24 horas. Transcurrido el tiempo se recolectaron las LI que se depositaron en el fondo del embudo de separación (paquete larvario), se lavaron 2 veces con solución amortiguadora de fosfatos (PBS), y posteriormente se observaron al microscopio en una cámara de Newbawer con lente de 10x 11. Al final se realizó el cálculo de la carga parasitaria (en 1 μl de paquete larvario se encuentran aproximadamente 25 LI).
Los datos se analizaron mediante la pruebas de Mann-Whitney. Se consideró un valor de p < 0.05 como estadísticamente significativo. El análisis estadístico se realizó mediante el paquete GraphPad Prism versión 5.
Resultados
Compresión en placa
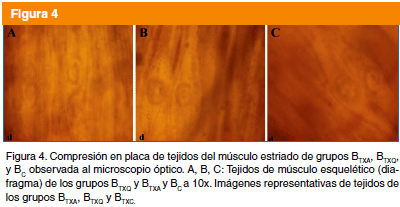
En los tejidos del grupo ATX no se encontró presencia de células nodrizas (Fig. 1A-B); mientras que en los tejidos del grupo control se encontraron LI probablemente en proceso de implantación, ya que se observaron aún desenrolladas (Fig. 1C).
En contraste al grupo ATX, los tejidos del grupo BTX si mostraron células nodrizas, pero al comparar estás con las del grupo control, se observaron algunas diferencias, entre las que destacan la presencia de la LI dentro de la célula nodriza sin adoptar completamente la forma de espiral, así como una cápsula muy difusa (Fig. 2A-B). La célula nodriza del grupo control muestra a la LI totalmente enrollada, y una cápsula definida que fácilmente se distingue en el tejido (Fig.2C).
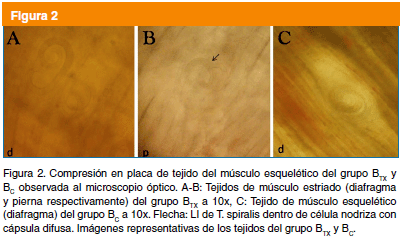
En la compresión en placa del grupo ATXQ se observó presencia de LI de apariencia similar al control, es decir, la LI se encontró al interior de la célula nodriza, aunque aún sin enrollar completamente (Fig. 3B-C). En contraste, el tejido del grupo ATXA no mostró ninguna célula nodriza (Fig. 3A). Las células nodrizas de los grupos BTXQ y BTXA tuvieron apariencia similar a BC. No se observó alguna diferencia aparente (Fig. 4A-B).
Hematoxilina y eosina
De acuerdo a los resultados obtenidos con la compresión en placa, no se encontró ninguna célula nodriza en tejidos del grupo ATX (Fig. 3A-B), mientras que los tejidos del grupo control, mostraron a una célula nodriza en formación, pues la LI aún se encontraba paralelamente a la miofibrilla, además se observó infiltrado celular y la desorganización del tejido muscular (Fig. 3C).
En los tejidos del grupo BTX se encontraron a células nodrizas con una cápsula delgada y menor definición respecto a la del grupo control, el infiltrado celular fue mayor y se observó en el interior de la célula nodriza (Fig. 4A-B). La célula nodriza del grupo control presentó una cápsula con mayor grosor, y el infiltrado celular se concentró en la periferia (Fig. 4C).
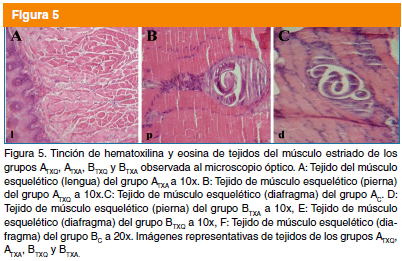
A excepción del grupo ATXA (Fig. 5A), en todos los tejidos se encontraron células nodrizas de apariencia similar al control (Fig. 5B-C-D-E). El grupo BTXA mostró mayor infiltrado celular respecto a los otros (Fig.5D).
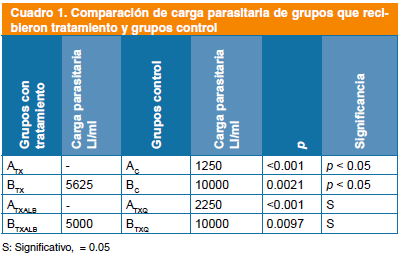
El paquete larvario se cuantificó para obtener la carga parasitaria de LI/ml. Los resultados son presentados como la mediana. Se analizaron mediante la prueba de Mann-Whitney, con una p < 0.05 (Fig. 5 y cuadro 1).
Discusión
El uso de benzimidazoles por periodos prologados puede ser causa de efectos embriotóxicos y teratogénicos en animales experimentales5,6, por lo que están contraindicados en mujeres embarazadas13. Se ha reportado que la administración de mebendazol durante el embarazo puede ser causa de efectos teratogénicos en el feto14. De ahí la importancia de contar con un tratamiento que sea eficaz contra la infección, pero con un periodo corto de administración. La asociación de medicamentos frecuentemente se usa por los beneficios terapéuticos obtenidos, en relación a sinergismo o potenciación10. Es por ello que actualmente existen en el mercado varios medicamentos que combinan la asociación de dos fármacos. En base a los resultados obtenidos, solamente se comprobó la eficacia terapéutica del medicamento durante fase intestinal. En el grupo ATX no se encontraron células nodrizas en tejidos del músculo esquelético (Fig. 1A-B). Durante la fase intestinal temprana del ciclo biológico de T. spirals, ocurre la implantación de la LI recién liberada de su cápsula en el epitelio columnar del intestino, evento de vital importancia para el establecimiento de la infecció15. La ausencia de células nodrizas en músculo esquelético, sugiere que la administración del medicamento durante fase intestinal temprana, impidió la invasión de las LI en el epitelio columnar, y por lo tanto no se estableció la infección. La observación de los tejidos de músculo esquelético de BC, mostró a células nodrizas ya maduras, pues se apreció una cápsula bien definida y una LI al interior con forma de espiral (Fig. 2C). Por el contrario, las LI de BTX se encontraron aún sin adoptar la forma de espiral, y con una cápsula difusa (Fig. 2A-B), similar a las características de célula nodriza inmadura observada en AC. Estas observaciones sugieren que la administración del medicamento a los siete días de infección de fase intestinal, no interfirió con el ciclo biológico del parasito, aunque probablemente retardo el proceso de maduración de la célula nodriza.
Con la cuantificación del paquete larvario obtenido por digestión artificial, se corroboró la ausencia de células nodrizas en tejidos del grupo ATX. La poca carga parasitaria obtenida en el grupo AC, probablemente se debió al hecho de que las células nodrizas eran inmaduras, ya que se observaron LI dentro de la cápsula, pero sin estar aún completamente enrolladas (Fig.1C), por otro lado, el poco grosor de la cápsula de colágena bien pudiera ser otro factor que contribuyó a la destrucción de las LI por la digestión artificial. Solo las células nodrizas maduras pueden resistir la digestión artificial1.
La carga parasitaria obtenida para el grupo BTX tuvo una disminución significativa con respecto al grupo BC, (p <0.05); estos resultados sugieren que la administración del medicamento a 7 días de evolución de la infección (fase intestinal), si tuvo un efecto terapéutico sobre la infección, pero no fue suficiente para impedir que el parásito continuara con el ciclo biológico. De haber existido sinergismo o potenciación en la acción de la quinfamida y/o albendazol probablemente tendría que haber ocurrido en fase intestinal, ya que la quinfamida solo actúa a nivel luminal8.
En los tejidos del grupo ATXALB, no se encontraron células nodrizas, ni se obtuvo paquete larvario (Fig. 3A, cuadro 1). Por el contrario, los tejidos del grupo ATXQ, mostraron células nodrizas de apariencia normal y la carga parasitaria fue similar a la obtenida en el grupo AC. Los tejidos del grupo BTXALB mostraron a LI sin enrollar totalmente (Fig.4A), mientras que las células nodrizas de BTXQ y BC tuvieron apariencia similar (Fig. 4B-C). La carga parasitaria de BTXALB tuvo una disminución significativa con respecto a BTXQ p < 0.05 (cuadro 1). Estos resultados son muy importantes, ya que se demostró que el albendazol ocasionó el efecto terapéutico observado en los grupos ATX, BTX, ATXALB y BTXALB, aunque el efecto fue menor para BTX y BTXALB, ya que el periodo de administración fue corto y como se había mencionado anteriormente, el albendazol si es efectivo contra la infección, pero solo si se administra por periodos prolongados13.
Conclusiones
Los resultados del grupo ATX mostraron que la administración del medicamento al comienzo de la infección, fue eficaz para impedir el establecimiento de la larva en el epitelio intestinal, por tanto no se completó el ciclo biológico de T. spiralis, lo anterior se comprobó por la ausencia de células nodrizas en tejido de músculo esquelético. Asimismo, el grupo BTX mostró una disminución significativa de carga parasitaria, respecto a su control p <0.05. Con los resultados obtenidos en los grupos ATXA, ATXQ y BTXA y BTXQ se comprobó que tal efecto terapéutico encontrado en los grupos ATX y BTX se debió simplemente a la acción del albendazol y no a la quinfamida o la acción sinérgica de la combinación de los medicamentos, por lo que no sería recomendable administrar el medicamento OXAL® para la triquinelosis, esperando tener mejores resultados solo por el hecho de ser un medicamento combinado.
Referencias
1. Camet, J.D., et al. 2002. Opinion on the diagnosis and treatment of human trichinellosis. Expert Opinion on Pharmacotherapy, 2002; 3(8): p. 1117-1130. [ Links ]
2. Benenson, A.S. Trichinellosis. In Control of communicable diseases in man, Apha, Editor. 1990: Washington, D.C. p. 446-448. [ Links ]
3. Flores, J. Fármacos antiparasitarios II. Helmintos y artrópodos. In Farmacología humana, Masson, Editor. 1997: Barcelona. p. 1239-1241. [ Links ]
4. Roach, S.S. Antiparasitic Drugs. In Introductory Clinical Pharmacology, L.W. Wilkins, Editor. 2007. p. 138-149. [ Links ]
5. Moreti, D.L.C., et al. 2005. Efectos del Albendazol en el Hígado de Feto de Rata. Estudios Morfológico y Morfométrico. International Journal of Morphology, 2005; 23(2): p. 111-120. [ Links ]
6. Chavez, E.G., et al., Detección de los cambios fenotipicos y genotipicos en productos de ratas long evans infectadas con Trichinella spiralis y tratadas con albendazol. In Biologia celular y microbiologia. 2009, Universidad Autonoma de Nuevo León: Monterrey Nuevo León. [ Links ]
7. Pharma-Pharmaceutical-Company, M.-. OXAL. 2008 13 de mayo de 2009]; Disponible en: http://morepharmacorp.com/oxal.php. [ Links ]
8. Galindo, L.F. Tratamiento de la amibiasis. In Amebiasis: enfoques actuales sobre su diagnóstico, tratamiento y control, Elfos, Editor. 2000. p. 151-153. [ Links ]
9. Cabello, R.R., et al. 2005. Evaluation of the efficacy and security of quinfamide administered in a single dose of 300 mg in adult patients with intestinal amebiasis. Parasitología Latinoamericana, 2005; 60: p. 57-60. [ Links ]
10. Cos, M.A.d. Interacciones de fármacos y sus implicaciones clínicas. In Farmacologia humana, Masson, Editor. 2003: Barcelona, España. p. 175-189. [ Links ]
11. Río, A.D., Herrera, D.R. and Herrera, R. 1986. Triquinosis experimental: extracción de antígenos y procedimientos para detectar anticuerpos. Archivos de Investigación Médica, 1986; 17: p. 359-367. [ Links ]
12. Ambrogi, L.P. Processing of Tissues. In Manual of Histologic and Special Staining Technics, A.F.I.o. Pathology, Editor. 1957: Washington, D.C. p. 7-16. [ Links ]
13. Rosenthal, P.J and Goldsmith, R.S. Farmacología clínica de los antihelmínticos. In Farmacologia básica y clínica, E.M. Moderno, Editor. 2005: México. p. 873-884. [ Links ]
14. Dubinski, P., et al. 2001. Congenital Trichinellosis? Case report. Parasite, 2001; 8: p. 180-182. [ Links ]
15. Rosa, J.L.d.l and Gómez, A. Trichinella y triquinosis. In Parasitología médica de las moléculas a la enfermedad. 2004: España. p. 219-225. [ Links ]
16. Despommier, D.D. and Muller, M. 1976. The Stichosome and Its Secretion Granules in the Mature Muscle Larva of Trichinella spiralis. The Journal of Parasitology, 1976; 62(5): p. 775-785. [ Links ]