Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR v.38 n.2 Caracas dic. 2007
Infección por VIH-1 en pacientes no progresores a largo tiempo
Gladys I Ameli M1, Cristina del R Gutiérrez G1.
1 Instituto Nacional de Higiene Rafael Rangel. Departamento de Virología. Tlf: 04142726624. Fax:02126934551, gladysameli@cantv.net.
RESUMEN:
El periodo entre la infección por el VIH y el desarrollo de SIDA es de diez años en promedio, pero un 5-10% de personas infectadas, llamadas no progresores a largo tiempo (NPLT), no desarrollan SIDA aún después de diez años de infección. Algunos factores pueden influir en el curso natural de la infección por VIH, tales como: 1) Factores de tipo ambiental, como infecciones por otros patógenos, que podrían estimular la replicación del VIH, acelerando el desarrollo de la inmunodeficiencia; 2) Características genéticas del huésped (repertorio HLA, perfil de citoquinas y quimioquinas, así como sus receptores), podrían justificar una diferente susceptibilidad frente al VIH-1; 3) Intensidad y diversidad de la respuesta inmune del huésped frente al virus; 4)Finalmente, la virulencia de las cepas predominantes del VIH en un individuo, explicaría la diferente progresión de la enfermedad en los pacientes infectados.
Palabras Clave: VIH, Síndrome de Inmunodeficiencia Adquirida, Carga viral, Células T CD4.
ABSTRACT:
The period between HIV infection and AIDS development is ten years on average, but 5-10% of people infected, named long term non progressors (LTNP), not development AIDS even ten years after infection. Some factors can to have influence in the HIV infection natural course, such as: 1) environment factors, such as infection for others pathogens that could stimulate the HIV replication, racing the immunodeficiency development; 2) host genetic characteristics (HLA repertoire, citokines and chemokines profile as soon as their receptors) justify a different susceptibility against HIV-1; 3) Intensity and diversity of host immunological response against the virus; 4)Finally, HIV predominant isolates virulence in an individual would explain the disease different progression in infected patients.
Key Words: HIV, Acquired Immunodeficiency Syndrome, Viral load, CD4 T cell.
INTRODUCCIÓN:
La mayoría de los pacientes infectados por el VIH (80-90%) progresan a SIDA, luego de los 5 años de la infección y son denominados progresores a mediano plazo (lento descenso en el recuento de células CD4 tras 5 años de haber adquirido la infección). Entre un 5-10% de las personas infectadas desarrollan SIDA tras la infección, constituyendo los llamados progresores rápidos. Otro 5-10% de los pacientes, asintomáticos y sin descenso en el recuento de células CD4+, tras 7 a 12 años de seguimiento sin tratamiento antirretroviral se les clasificó como no progresores a largo tiempo (1, 2, 3,4).
La variabilidad interindividual en la progresión a SIDA se relaciona con numerosos factores que modifican la compleja relación: entre VIH y el ser humano durante la infección, ya sea aumentando o disminuyendo la carga viral ó la respuesta inmunitaria del huésped, particularmente la celular citotóxica (5).
A continuación se tratarán algunos aspectos sobre los pacientes con VIH no progresores a largo tiempo así como los factores ambientales, virales, genéticos e inmunológicos del huésped que influyen en la lenta progresión a SIDA observada en estos individuos.
CURSO NATURAL DE LA INFECCIÓN POR VIH:
Desde el punto de vista clínico-virológico se distinguen las siguientes fases evolutivas en la historia natural de la infección:
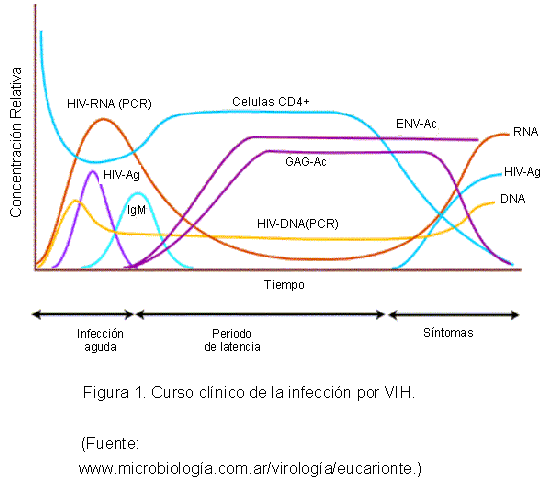
1. Fase precoz o aguda: La enfermedad por VIH comienza con una infección aguda, sólo parcialmente controlada por la respuesta inmunológica del hospedador, y evoluciona a una infección progresiva crónica de los tejidos linfoides periféricos. A medida que la infección viral se disemina, el sistema inmunológico, a través de respuestas humorales y celulares dirigidas contra los antígenos virales, puede controlar parcialmente la producción de virus, lo cual se refleja en el descenso de la viremia a niveles bajos o indetectables a las doce semanas aproximadamente de la exposición primaria (1) (ver Figura 1).
Días después de la primera exposición al VIH, es posible detectar una notable replicación viral en los ganglios linfáticos. Las células dendríticas desempeñan un papel en la diseminación inicial del VIH a los tejidos linfoides, debido a que su función normal consiste en atrapar los antígenos en los epitelios y luego migrar a los ganglios linfáticos, donde pueden transferir el VIH a las células T CD4+ mediante contacto célula-célula (2).
2. Fase de latencia ó intermedia: Después de la infección aguda inicial, se desarrolla una segunda fase de la enfermedad durante la cual los ganglios linfáticos y el bazo se convierten en sitios de replicación continua del VIH (1). Durante este período, el sistema inmunológico es capaz de controlar la mayoría de las infecciones debidas a otros microorganismos, existiendo escasas manifestaciones clínicas de la enfermedad. La duración de este período depende de factores relacionados con el hospedero, del tamaño del inóculo y de la eficacia de la terapia antirretroviral. Sin embargo, la destrucción de las células T CD4+ en los tejidos linfoides continúa en progreso, disminuyendo en sangre constantemente (2).
3. Fase final: Durante la progresión crónica de la enfermedad por el VIH, la respuesta inmunológica del paciente a otras infecciones puede estimular la producción del VIH y acelerar la destrucción de los tejidos linfoides. En los estadios finales, se produce una marcada linfopenia, disminuyendo el recuento de células T CD4+ en la sangre por debajo de 200 células/mm3. Por lo tanto, la respuesta inmunológica es inhibida, debido a que el VIH infecta y destruye los linfocitos T CD4+ que podrían ayudar a amplificar la respuesta inmunológica contra el virus. Es entonces cuando se desarrollan las infecciones oportunistas y neoplasias que definen el SIDA (2).
PACIENTES NO PROGRESORES A LARGO TIEMPO:
Generalmente el tiempo entre la infección por el VIH y el desarrollo de SIDA es de diez años en promedio, pero un pequeño porcentaje de personas infectadas, llamadas no progresores a largo tiempo (NPLT), no desarrollan SIDA aún después de diez años de infección (3).
Los pacientes NPLT, se caracterizan por ser asintomáticos, con infección por VIH por al menos ocho años, niveles bajos de ARN viral, estabilidad en el contaje de linfocitos T CD4+ (mayor a 500 células/mm3) y sin tratamiento antirretroviral (4,5). Igualmente, se ha descrito una respuesta humoral contra el virus aumentada y una respuesta celular citotóxica mediada por la actividad antiviral exacerbada de los linfocitos T citotóxicos CD8+ (5).
Los pacientes NPLT, han sido identificados en varios grupos de riesgo: hombres homosexuales, mujeres, usuarios de drogas intravenosas y niños (5).
En un estudio de Rutherford y col. entre 1978-1980 en 539 pacientes homosexuales y bisexuales con fecha conocida de seroconversión, se encontró que la tasa de progresión a SIDA fue: 51% a los diez años. Un 8% de los pacientes presentaron cifras de linfocitos T CD4+ mayores a 500 células/mm3 luego de más de diez años de infección por VIH (6).
Phair y col. encontraron en 1984, que de los 1.090 pacientes con VIH en el momento de iniciarse el estudio al menos un 15% de la población mantenía cifras estables de linfocitos T CD4+ a los siete años de monitoreo (7).
En 1992, Learmont y col. describen un grupo de siete receptores de transfusiones a partir de una sola donación de un paciente que había seroconvertido para VIH-1 en 1980-1981, poco antes de donar sangre (8). Para el momento del estudio tanto el donante como seis de los receptores, que eran seropositivos, permanecían con vida, asintomáticos con cargas virales indetectables y con cifras normales o poco alteradas de linfocitos TCD4+ (9).
Soriano y col. en 1992, compararon las características epidemiológicas entre los pacientes con VIH progresores lentos y rápidos, encontrándose un 5,6% de los pacientes con valores mayores a 500 células T CD4+/mm3 y sin tratamiento antirretroviral. La mayoría de los pacientes incluidos como progresores lentos referían haber sido usuarios de drogas endovenosas (4).
FACTORES QUE INFLUYEN EN EL CURSO DE LA INFECCIÓN POR VIH EN PACIENTES NPLT:
Las variables que pueden influir en el curso natural de la infección por VIH pueden ser clasificadas en los siguientes grupos:
Factores ambientales
Se ha demostrado un incremento de la producción viral en la coinfección con otros agentes infecciosos que in vivo, podrían acelerar la inmunodeficiencia producida por el VIH, tal es el caso de: citomegalovirus, micoplasmas, virus del herpes simple 1 y 2, algunos adenovirus y papovavirus, el virus de la hepatitis B, el virus de Epstein-Barr, los retrovirus HTLV-I y II, el VIH-2 y el virus de hepatitis C (10). En relación a este último agente, la hepatitis C crónica puede constituir un cofactor de progresión a SIDA y muerte en los pacientes coinfectados por VIH (11, 12, 13). Sin embargo, en un estudio realizado, se encontró que la mayoría de los pacientes progresores lentos evaluados presentaban marcadores serológicos para los virus de hepatitis B y C, siendo muchos de ellos diagnosticados con hepatopatías crónicas por el virus de hepatitis C (4). En otro estudio, se observó una asociación entre la presencia de anticuerpos dirigidos contra el virus de hepatitis C y bajos niveles (<3,65 log) de ARN genómico del VIH (P=0,001). (Gutiérrez C., DAngelo P., comunicación personal 2006, datos no publicados).
Algunos estudios han demostrado que personas coinfectadas con el virus de hepatitis G (GBV-C) y el virus de inmunodeficiencia humana (VIH-1) parecen tener una mayor probabilidad de supervivencia que personas no coinfectadas (14). Tambièn se ha encontrado que presentan un contaje de células T CD4+ más alto y menor carga viral en comparación con pacientes no coinfectados. Se ha reportado una correlación inversa entre la carga viral del VIH y las concentraciones de ARN plasmático del GBV-C, al igual que una alteración en el perfil de citoquinas (15,16, 17).
Factores genéticos del huésped
1. Antígenos Leucocitarios Humanos (ALH)
Los ALH son un grupo de genes que pertenecen al Complejo Principal de Histocompatibilidad (CPH) localizado en el cromosoma 6 humano, que ayudan a regular la respuesta inmunológica, diferenciando los antígenos propios de los no propios. Se ha asociado la presencia de ciertos alelos del CPH con progresión lenta: HLA-B27, B57 y B51 (18). En un estudio realizado en NPLT se demostró una fuerte asociación entre la presencia del alelo de clase I B*5701 y la infección no progresiva (19).
2. Polimorfismos de las Quimioquinas y de sus receptores.
Las quimioquinas son sustancias quimioatrayentes secretadas por células, tales como los Linfocitos T CD8+ (LT CD8+) en el sitio de la infección para regular el movimiento y actividad de las células inmunológicas en los tejidos. Las quimioquinas secretadas se unen a otras células a través de sus receptores específicos presentes en la superficie de las células blanco (20). El VIH-1 necesita de dos receptores para entrar en las células humanas: el receptor CD4+ presente en algunas células del sistema inmunológico y los receptores de quimioquinas, los cuales son co-receptores necesarios para la entrada del VIH-1 en las células CD4+. La mayoría de las cepas circulantes del VIH-1 utilizan el co-receptor de quimioquinas CCR5 y se conocen como cepas macrófago-trópicas (M-trópicas) (21,22). Este co-receptor está presente en macrófagos, monocitos y algunas células T (21,23). Otros subtipos de HIV, llamados virus T-trópicos, requieren su unión al co-receptor de quimioquinas CXCR4, además de unirse al receptor CD4+. Este co-receptor se ubica sobre la superficie de células T (24,25).
Algunas cepas M-trópicas del VIH pueden usar otros co-receptores como CCR2 o CCR3, en lugar de CCR5 para entrar a los macrófagos (26, 27).
Los receptores de quimioquinas al ser usados por el VIH como co-receptores para la entrada a la célula sugiere el papel de estas moléculas como factores genéticos del huésped que pueden afectar la susceptibilidad a la infección por VIH o la velocidad de progresión de la enfermedad una vez que el individuo se infecta (28).
Se ha descrito una mutación en el gen CCR5, conocida como CCR5 –D32, la cual consiste en una deleción de 32 pares de bases en el segmento del gen que codifica para la segunda asa extracelular de la proteína, dando como resultado una proteína defectiva frecuente en personas infectadas por VIH no progresoras a largo tiempo, lo cual sugiere que esta mutación parece influir en la velocidad de progresión de la enfermedad (29,30, 31, 32).
El CCR2 es otro co-receptor usado por las cepas M-trópicas del VIH (33). Un polimorfismo en la posición 64 del gen CCR2 (CCR2-V64I) parece conferir una progresión más lenta a SIDA (34,35, 36, 37).
Factores inmunológicos del huésped:
1. Respuesta inmunitaria celular por Linfocitos T CD8+ Citotóxicos (LTC)
Cómo se mencionó en el curso natural de la infección por VIH, después de la exposición al VIH se produce una fase de viremia aguda que luego se resuelve coincidiendo con la aparición de LTC específicos contra el virus (38,39). Sin embargo, en un porcentaje reducido de pacientes NPLT se ha observado respuestas por LTC intensas y dirigidas a un amplio repertorio de epítopes virales, en comparación con pacientes progresores (40,41).
La respuesta inmunológica por LTC dirigida específicamente a las proteínas de la cápside viral, parece estar asociada con disminución de la progresión de la enfermedad por VIH (42,43). El reconocimiento de ciertos epítopes presentados por moléculas del CPH clase I a los LTC, puede originar una potente actividad anti-viral (44), lo cual podría explicar la asociación de diferentes alelos clase I del CPH con la progresión lenta de la infección (18).
2. Respuesta inmunitaria celular por Linfocitos T CD4+ Cooperadores (LT CD4+)
Los LT CD4+ son reguladores de la respuesta inmunitaria, siendo necesarios para el mantenimiento de la actividad de los LTC (45).
Se han diferenciado dos tipos de respuesta inmunológica de los LT CD4+, en base al perfil de citoquinas producido: la respuesta inmunitaria tipo 1 (Th1) estimula la inmunidad efectora celular y se caracteriza por la producción de interleuquina 2 (IL-2), interferón gamma e interleuquina 12 (IL-12) y una respuesta inmunitaria tipo 2 (Th2) desencadena la producción de anticuerpos específicos y se asocia a la producción de las interleuquinas 4 (IL-4), 6 (IL-6) y 10 (IL-10) (46). Se ha observado que inóculos pequeños del virus pueden desencadenar una respuesta tipo Th1 y exposiciones a una mayor cantidad de virus, una respuesta Th2, siendo la respuesta Th1 protectora frente a inóculos posteriores (47). Quizás esta observación pueda explicar, la progresión lenta de la infección en algunos pacientes.
3. Factores solubles antivirales
Se han descrito algunas quimioquinas producidas por los LTC que parecen mediar esta acción, como RANTES, MIP-1a y MIP-1b (48,49); estas moléculas ejercen su acción inhibitoria uniéndose a sus ligandos naturales (co-receptores CCR5) usados por el virus para entrar a la célula. También se ha descrito la acción reguladora negativa sobre su co-receptor CXCR4 producida por la quimioquina SDF-1 (50). Algunos estudios en pacientes NPLT han demostrado una mayor respuesta antiviral mediada por factores solubles derivados de los LTC en comparación con los pacientes progresores (51).
4. Respuesta inmunológica humoral.
La relación entre la respuesta inmunológica humoral y la progresión de la enfermedad por VIH es incierta (52). En la infección no progresiva se ha observado una falta de respuesta de anticuerpos dirigida contra el epítope correspondiente a los residuos de aminoácidos 503-528 de la región c-terminal de la gp120, con mantenimiento de altos niveles de anticuerpos específicos dirigidos a la proteína p24, así como de anticuerpos neutralizantes (53).
Factores intrínsecos del genoma viral:
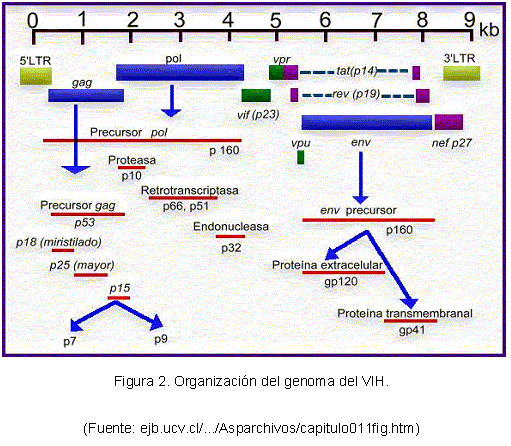
El VIH-1 presenta tres genes estructurales: gag, pol y env. Además, contiene seis genes reguladores: tat, rev, vif, nef, vpr y vpu (ver Figura 2), cuyos productos regulan la reproducción viral de diversas formas (54).
En los pacientes NPLT se ha encontrado que el VIH aislado es un tipo no virulento con mutaciones por deleción en la región nef. Se ha observado una alta frecuencia de la mutación R77Q en la proteína vpr del virus, la cual podría eliminar la habilidad de la vpr de inducir apoptosis en los LT CD4+ (55).
Finalmente, la mayor o menor virulencia de las cepas víricas predominantes en un individuo, explicaría la diferente progresión de la enfermedad en los pacientes infectados (54, 55).
En conclusión, son diversas las variables que pueden influir en el curso natural de la infección por VIH. Inicialmente, encontramos factores de tipo ambiental, como infecciones por otros patógenos, que podrían estimular la replicación del VIH, acelerando el desarrollo de la inmunodeficiencia. En segundo lugar, distintas características genéticas del huésped (repertorio HLA, perfil de citoquinas y quimioquinas, así como de sus receptores), podrían justificar una diferente susceptibilidad frente al VIH-1. Igualmente, otro factor lo constituye la intensidad y diversidad de la respuesta inmunitaria del huésped frente al virus. Finalmente, la mayor o menor virulencia de las cepas víricas predominantes en un individuo, explicaría la diferente progresión de la enfermedad en los pacientes infectados por VIH.
REFERENCIAS BIBLIOGRAFICAS:
1. Coffin, J. HIV viral dynamics. AIDS. 1996; 10 Suppl 3:75-84. [ Links ]
2. Pantaleo G., Graziosi C., Fauci A. The immunopathogenesis of human immunodeficiency virus infection. The New England Journal of Medicine. 1993; 328(5):327-335. [ Links ]
3. Suzuki Y., Yamamoto N. HIV infection and long term non progressor. Nippon Rinsho. 1997; 55(6):1563-71. [ Links ]
4. Soriano V, Martín R, Del Romero J, Castilla J, Bru F, Bravo R et al. Characterization of rapid and show progressors in a cohort of HIV-infected individuals in Madrid (resumen). AIDS. 1994; 8 (Suppl 4): 2. [ Links ]
5. Easterbrook PJ. Long term non-progression in HIV infection: definitions and epidemiological issues. J Infect. 1999; 38(2):71-73. [ Links ]
6. Rutherford G, Lifson A, Hessol N, Darrow WW, O'Malley PM, Buchbinder SP, et al. Course of HIV-1 infection in a cohort of homosexual and bisexual men: an 11 year follow up study. Br Med J. 1990; 301:1183-1188. [ Links ]
7. Phair J, Jacobson L, Detels R, Rinaldo C, Saah A, Schrager L, et al. Acquired immune deficiency syndrome occurring within 5 years of infection with HIV type 1: the Multicenter AIDS Cohort Study. J AIDS. 1992; 5:490-496. [ Links ]
8. Learmont J, Tindall B, Evans L, Cunningham A, Cunningham P, Wells J, et al. Long-term symptomless HIV-1 infection in recipients of blood products from a single donor. Lancet. 1992; 340:863-867. [ Links ]
9. Deacon NJ, Tsykin A, Solomon A, Smith K, Ludford-Menting M, Hooker DJ, et al. Genomic structure of an attenuated quasi species of HIV-1 from a blood transfusion donor and recipients. Science. 1995;270:988-991. [ Links ]
10. Benito JM, Soriano Vicenç y Del Romero J. Cofactores. Progresores rápidos y lentos. En: Soriano Vicenç, González-Lahoz J, editors. Manual del SIDA. 5ta ed.; 2003. p.157-169. [ Links ]
11. Greub G, Ledergerber B, Battegay M, Grob P, Perrin L, Furrer H, et al. Clinical progression, survival, and immune recovery during antiretroviral therapy in patients with HIV-1 and hepatitis C virus coinfection: the Swiss HIV Cohort Study. Lancet. 2000;356:1800-1805. [ Links ]
12. Martín J, López M, Arranz R, Perez-Olmeda M, Martinez P, Gonzalez-Lahoz J, et al. Impact of hepatitis C in HIV-infected individuals in an urban center in Madrid, Spain. En: 8th Conference on Retroviruses & Opportunistic Infections; 2001; Chicago, (abstract 572). [ Links ]
13. Soriano V, Kirk O, Antunes F, et al. The influence of hepatitis C on the prognosis of HIV: The EuroSIDA Study. En: XIII Int AIDS Conf.; 2000; Durban, (abstract ThOrB655). [ Links ]
14. Xiang J, Wunschmann S, Diekema DJ, Klinzman D, Patrick KD, Sarah L, et al. Effect of coinfection with GB virus C on survival among patients with HIV infection. New Eng J Med. 2001; 345(10):707-714. [ Links ]
15. Nunnari G, Nigro L, Palermo F, Atanasio M. Slower progresión of HIV-1 infection in persons with GB virus C coinfection correlatos with an intact T helper 1 citokine profile. Ann Int Med. 2003; 139: 26-30. [ Links ]
16. Garzino A, De Vico A, Gallo R. The rol of chemokinas in human immunodeficiency virus infection. Inmunoll Rev. 2000; 177:79-87. [ Links ]
17. Crowe K. Cytoquines and HIV-1: interactions and clinical implications. Antivir Chem Chemother. 2001;12 (3):133-150. [ Links ]
18. Kaslow RA, Carrington MN, Apple R, Park L, Muñoz A, Saah AJ, et al. Influence of combination of human major histocompatibility complex genes on the course of HIV-1 infection. Nat Med. 1996; 2:405-410. [ Links ]
19. Migueles SA, Sabbagian MS, Shupert W, Bettinotti MP, Marincola FM, Martino L, et al. HLA B* 5701 is highly associated with restriction of virus replication in a subgroup of HIV-infected lon term non-progressors. Proc Natl Acad Sci USA. 2000; 97: 2709-2714. [ Links ]
20. Luster AD. Chemokines-chemotactic cytokines that mediate inflammation. N Engl J Med. 1998; 338:436-445. [ Links ]
21. Alkhatib G, Combadiere C, Brode CC, Feng Y, Kennedy PE, Murphy PM, et al. CC CKR5: a RANTES, MIP-1a, MIP-1b receptor as a fusion cofactor for macrophage-tropic HIV-1. Science. 1996; 272:1955-1958. [ Links ]
22. Choe H, Farzan M, Sun Y, Sullivan N, Rollins B, Ponath PD, et al. The b-chemokine receptors CCR3 and CCR5 facilite infection by primary HIV-isolates. Cell. 1996; 85:1135-1148. [ Links ]
23. Deng H, Liu R, Ellmeier W, Choe S, Unutmaz D, Burkhart, et al. Identification of a major co-receptor for primary isolates of HIV-1. Nature. 1996; 381:661-666. [ Links ]
24. Feng Y, Broder C, Kennedy PE, Berger EA. HIV-1 entry cofactor: functional cDNA cloning of a seven-transmembrane G protein-coupled receptor. Science. 1996; 272: 872-877. [ Links ]
25. Dale H, Dondero T, Rayfield M, George R, Schochetman G, Baggs J, et al. The emerging genetic diversity of HIV. JAMA. 1996; 275:210-215. [ Links ]
26. Zhang K, Huang Y, He T, Cao Y, Ho D. HIV-1 subtype and second receptor use. Nature. 1996; 383:768. [ Links ]
27. Simmons G, Wilkinson D, Reeves JD, Dittmar MT, Beddows S, Weber J, et al. Primary, syncytium-inducing human immunodeficiency virus type 1 isolates are dual-tropic and most can use either Lestr or CCR5 as co-receptors for virus entry. J Virol. 1996; 70:8355-8360. [ Links ]
28. Ramírez C. Influencia de los factores genéticos del huésped en la infección por el VIH. Act Cient de la Soc Venez de Bioanal Espec. 2001; 7(2):37-48. [ Links ]
29. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber CM, et al. Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR5 chemokine receptor gene. Nature. 1996; 382:722-725. [ Links ]
30. Liu R, Paxton WA, Choe S, Ceradini D, Martin SR. Homozygous defect in HIV-1 coreceptor accounts for resistance of some multiply-exposed individuals to HIV-1 infection. Cell. 1996; 86:367-377. [ Links ]
31. Zimmerman P, Buckler-White A, Alkhatib G, Spalding T, Kubofcik J, Combadiere C, et al. Inherited resistance to HIV-1 conferred by an inactivating mutation in CC chemokine receptor 5: studies in populations with contrasting clinical phenotypes, defined racial backgrounds and quantified risks. Mol Med. 1997; 3:23-36. [ Links ]
32. Dean M, Carrington M, Winkler C, Huttley GA, Smith MW, Allikmets R, et al. Genetic restriction of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene. Science. 1996; 273:1856-1862. [ Links ]
33. Hogan CM, Hammer SM. Host determinants in HIV infection and disease. Part 2: genetic factors and implications for antiretroviral therapeutics. Ann Intern Med. 2001; 134(10):978-996. [ Links ]
34. Smith MW, Dean M, Carrington M, Winkler C, Hurtley GA, Lomb DA, et al. Contrasting genetic influence of CCR2 and CCR5 variants on HIV-1 infection and disease progression: Hemophilia Growth and Development Study, Multicenter AIDS Cohort Study (MACS), Multicenter Hemophilia Cohort Study (MHCS), San Francisco City Cohort (SFCC), ALIVE Study. Science. 1996; 277:959-965. [ Links ]
35. Meyer L, Magierowska M, Hubert JB, Theodorou I, van Rij R, Prins M, et al. C-C chemokine receptor variants, SDF-1 polymorphism, and disease progression in 720 HIV-infected patients: SEROCO Cohort. Amsterdam Cohort Studies on AIDS [Letter]. AIDS. 1999; 13:624-626. [ Links ]
36. Loannidis JP, OBrien TR, Rosenberg PS, Contopoulos-Ioannidis DG, Goedert JJ. Genetic effects on HIV disease progression [Letter]. Nat Med. 1998; 4:536. [ Links ]
37. Schinkel J, Langendam MW, Coutinho RA, Krol A, Brouwer M, Schuitemaker H. No evidence for an effect of the CCR5D32/+ and CCR2b 64I/+ mutations on human immunodeficiency virus (HIV)-1 disease progression among HIV-1 infected injecting drug users. J Infect Dis. 1999; 179:825-831. [ Links ]
38. Mackewicz C, Yang L, Lifson J, Levi J. Non-cytolitic CD8 T cell anti-HIV responses in primary HIV-1 infection. Lancet. 1994; 344:1671-1673. [ Links ]
39. Koup R, Safrit J, Cao Y, Andrews CA, McLeod G, Borkowsky W et al. Temporal association of cellular immune responses with the initial control of viremia in primary HIV-1 syndrome. J Virol. 1994; 68:4650-4655. [ Links ]
40. Harrer T, Harrer E, Kalams S, Barbosa P, Trocha A, Johnson RP, et al. Cytotoxic T lymphocytes in asymptomatic long-term nonprogressing HIV-1 infection: breadth and specificity of the response and relation to in vivo viral quasispecies in a person with prolonged infection and low viral load. J Immunol. 1996; 156: 2616-2623. [ Links ]
41. Pantaleo G, Menzo S, Vaccarezza M, Graziosi C, Cohen OJ., Demarest JF et al. Studies in subjects with long-term nonprogressive human immunodeficiency virus infection. N Engl J Med. 1995; 332: 209-216. [ Links ]
42. Klein MR, Van Baalen CA, Holwerda AM, Kerkhof Garde SR, Bende RJ, Keet IP, et al. Kinetics of gag-specific cytotoxic T lymphocyte responses during the clinical course of HIV-1 infection: a longitudinal analysis of rapid progressors and long-term asymptomatics. J Exp Med. 1995; 181:1365-1372. [ Links ]
43. Riviere Y, McChesney MB, Porrot F, Tanneau-Salvadori F, Sansonetti P, Lopez O et al. Gag-specific cytotoxic responses to HIV type 1 are associated with a decreased risk of progression to AIDS-related complex or AIDS. Res Hum Retroviruses. 1995; 11:903-907. [ Links ]
44. Goulder PJ, Bunce M, Krausa P, McIntyre K, Crowley S, Morgan B et al. Novel, cross-restricted, conserved, and immunodominant cytotoxic T lymphocyte epitopes in slow progressors in HIV type infection. AIDS Res Hum Retroviruses. 1996; 12: 1691-1698. [ Links ]
45. Matloubian M, Ahmed R. CD4+ T cells are required to sustain CD8+ cytotoxic T-cell responses during chronic viral infection. J Virol. 1994; 68:8056-8063. [ Links ]
46. Romagnani S. Induccion of TH1 and TH2 responses: a key role for the natural immune response?. Immunol Today. 1992; 13:379-381. [ Links ]
47. Lehner T, Brookes R. Panagiotidi I. T and B cell expression in non-human primates immunized with SIV antigen by the rectal route. Proc Natl Acad Sci USA. 1993; 90:8638-8642. [ Links ]
48. Cocchi F, De Vico A, Garzino-Demo A, Arya S, Gallo R, Lusso P. Identification of RANTES, MIP-1alpha, and MIP-1beta as the mayor HIV suppressive factors produced by CD8+ T cells. Science. 1995; 270: 1811-1815. [ Links ]
49. Kinter AL. HIV replication in CD4+ T cells of HIV-infected individuals is regulated by a balance between the viral suppressive effects of endogenous beta-chemokines and the viral inductive effects of other endogenous cytokines. Proc Natl Acad Sci USA. 1996; 93:14076-14081. [ Links ]
50. Amara A, Gall SL, Schwartz O, Salamero J, Montes M, Royal S, et al. HIV receptor downregulation as antiviral principle: SDF-1 alpha-dependent internalization of the chemokine receptor CXCR4 contributes to inhibicion of HIV replication. J Exp Med. 1997; 186:139-146. [ Links ]
51. Scala E. C-C chemokines, IL-16, and soluble antiviral factor activity are increased in cloned T cells from subjects with long-term nonprogressive HIV infection. J Immunol. 1997; 158:4485-4492. [ Links ]
52. Zwart G. Antibody responses to HIV-1 envelope and gag epitopes in HIV-1 seroconverters with rapid versus slow disease progression. Virology. 1994; 201:285-293. [ Links ]
53. Wong MT, Waren R, Anderson S. Longitudinal analysis of the humoral immune response to human immunodeficiency virus type 1 (HIV-1) gp 160 epitopes in rapidly progressing and nonprogressing HIV-1-uninfected subjects. J Infect Dis. 1993; 168:1523-1527. [ Links ]
54. Hodge CN, Straatsma TP, Mc Cammon and Wlodawer, A. En: Chiu W, Burnett R and Garcea R, editors. Structural Biology of Viruses. Oxford University Press; 1997. p.451-473. [ Links ]
55. Lum J, Cohen O, Nie Z, Weaver J, Gomez T, Yao Xiao-Jian, et al. Vpr R77Q is associated with long-term nonprogressive HIV infection and impaired induction of apoptosis. J Clin Invest. 2003; 111(10):1547-1554. [ Links ]











 uBio
uBio