Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.28 n.1 Caracas jun. 2008
Primer reporte de infección natural por Nocardia cyriacigeorgica en ratones BALB/c
Olga Carolina Rojasa, Carlos Medinaa,*, Lila Rumenoffa, Oscar Suáreza, Emilio Martíneza, José Antonio Serranob, Elizabeth Liendoa, Mayela Uzcátegui-Negrónb, Patrick Boironc, Verónica Rodríguez-Navac, Andrée Coublec, Delphine Mouniéec, Karina Sánchez Herrerad, Horacio Sandovald, William Lópeza, Elis Mosqueraa, Joanna Santeliza
aDecanato de Medicina, Universidad Centroccidental "Lisandro Alvarado" (UCLA), Barquisimeto, Venezuela
bFacultad de Farmacia, Universidad de Los Andes (ULA), Mérida, Venezuela
cUniversité de Lyon, Lyon, Université Lyon1 y CNRS, UMR5557 Ecologie Microbienne, Villeurbanne, France
dUniversidad Autónoma Metropolitana-Xochimilco, México DF, México
* Correspondencia: E-mail: carlos_medina@cantv.net
Resumen:
Las bacterias del género Nocardia son actinomicetos aerobios cuyo hábitat es el suelo y la materia orgánica en descomposición. La infección natural por especies de este género ha sido reportada en humanos y animales, sin embargo, la infección natural en ratones no ha sido descrita. En este estudio se demuestra por primera vez el aislamiento de la especie recientemente descrita, Nocardia cyriacigeorgica, en pulmones de ratones Balb/c. El estudio microbiológico de las muestras de pulmón reportó la presencia de filamentos grampositivos ramificados fragmentados en forma cocobacilares. Los estudios de PCR demostraron que la especie aislada fue N. cyriacigeorgica. Se evidencia en este trabajo que N. cyriacigeorgica es potencialmente patógena en ratones Balb/c.
Palabras claves: Nocardia cyriacigeorgica, ratones Balb/c, pulmón, nocardiosis, infección natural
First report of a natural infection by Nocardia cyriacigeorgica in BALB/c mice
Abstract:
Bacteria belonging to the Nocardia genus are aerobic actinomycetae whose habitat is the ground and decomposing organic material. Natural infection by species belonging to this genus has been reported in humans and animals; nevertheless, natural infection in mice has not been described until now. This study demonstrates for the first time the isolation of a recently described species, Nocardia cyriacigeorgica, rom the lungs of Balb/c mice. The microbiological study of the lung samples reported the presence of branched Gram positive filaments with a cocobacillar shape. PCR studies demonstrated that the species isolated was N. cyriacigeorgica. This study demonstrates that N. cyriacigeorgica is potentially pathogenic for Balb/c mice.
Keywords: Nocardia cyriacigeorgica, Balb/c mice, lung, nocardiosis, natural infection
Recibido 14 de agosto de 2007; aceptado 28 de abril de 2008
Introducción
La primera descripción de una enfermedad del ganado bovino causada por un actinomiceto aerobio se atribuye al veterinario francés Edmond Nocard en 1888. Al año siguiente Trevisan creó el género Nocardia y caracterizó el agente etiológico aislado por Nocard, otorgándole el nombre de Nocardia farcinica. En 1890 Eppinger aisló, en un paciente con un absceso cerebral, un microorganismo filamentoso aeróbico similar al anteriormente descrito por Trevisan, que posteriormente recibiría el nombre de Nocardia asteroides [1,2]. A partir de la identificación de las primeras especies de este género, un número substancial de casos de nocardiosis tanto en animales como en humanos han sido reportados, reconociendo a estos microorganismos como agentes causales de infecciones oportunistas en organismos inmunocompetentes e inmunocomprometidos.
El género Nocardia actualmente incluye aproximadamente 50 especies de bacterias aerobias estrictas, irregularmente grampositivas y parcialmente ácido resistentes, nutricionalmente poco exigentes, las cuales toleran un pH entre 6.5 y 9 y crecen a temperaturas entre 10 0C y 50 0C. Habitualmente se encuentran como elementos saprófitos en agua dulce y salada, suelo, materia orgánica en descomposición y heces fecales de animales [3]. El suelo es el hábitat preferencial de este grupo de actinomicetos, constituyendo hasta un 25% de la microflora edáfica en zonas áridas. Es de hacer notar que los suelos de la región centroccidental de Venezuela son ricos en Nocardia asteroides, considerándose esta área como un reservorio natural de esta especie [4].
La clasificación taxonómica de este género ha sido problemática. Una característica morfológica distintiva del género Nocardia es la fragmentación de las células filamentosas en elementos cocoides o bacilares en muestras clínicas o cultivos primarios. Sin embargo, esta no es una característica patognomónica de este género. Las pruebas bioquímicas de hidrólisis de xantina, hipoxantina, tirosina y caseína y las pruebas de descomposición de urea y resistencia a la lisozima permiten la diferenciación de las especies patógenas de Nocardia más importantes (N. asteroides, N. brasiliensis y N. otitidiscaviarum), sin embargo estas técnicas no permiten diferenciar el complejo de N. asteroides de otras nocardias no patógenas (Nocardia camea) o de especies de otros géneros tales como Mycobacterium, Rhodococcus, Gordona y Tsukamurella [1]. Actualmente, la definición de las especies del género Nocardia se basa fundamentalmente en información filogenética molecular dada por la secuencia génica del ARN ribosomal 16S y del gen hsp65 [3,5,6].
Numerosos estudios han señalado la importancia del género Nocardia como agente causal de procesos infecciosos en animales. Se han reportado infecciones naturalmente adquiridas en múltiples especies de animales salvajes y domésticos, entre ellas cabe mencionar los bovinos [7-9], caballos [10], perros [11,12], peces [13,14] y aves [15-17], entre otros. Nocardia asteroides es el patógeno más frecuentemente aislado en estos animales, seguido de N. brasiliensis y N. otitidiscaviarum [2]. Sin embargo, hasta ahora no se ha reportado la infección natural de estas bacterias en roedores. En este trabajo se presenta por primera vez el hallazgo de una Nocardia en pulmones de ratones Balb/c identificada a través de pruebas moleculares como una especie recientemente descrita, N. cyriacigeorgica.
Materiales y Métodos
Animales
Treinta ratones Balb/c femeninos de 4 semanas de edad y de aproximadamente 20 ± 4 gramos de peso, solicitados para un estudio de investigación, fueron hospedados en el Bioterio del Decanato de Ciencias de la Salud de la Universidad Centroccidental Lisandro Alvarado (UCLA), Barquisimeto, estado Lara, Venezuela. Cada animal se mantuvo individualmente en una jaula de policarbonato estéril de 189 mm (ancho) x 297 mm (largo) x 128 mm (alto), con camas compuestas de cáscaras de arroz. El estado microbiológico de los ratones fue convencional, sin barrera. La temperatura ambiente del bioterio oscilaba entre 28-30oC y la iluminación correspondía a un ciclo día-noche de 12 horas. Los ratones eran alimentados con pellets de la marca comercial Ratarina® no autoclavada y agua ad libitum. Los ratones mantenidos en estas condiciones fallecieron espontáneamente aproximadamente a los 7 ± 3 días de su llegada del bioterio.
Anatomia patológica
Para el análisis histopatológico, los pulmones fueron removidos y fijados en formalina neutra al 10%. Posteriormente fueron lavados con etanol al 70%, deshidratados y embebidos en metacrilato de glicol. Se procedió a realizar cortes de 10 μm y dichas secciones fueron montadas en portaláminas y teñidas con hematoxilina y eosina. Se evaluaron cuatro secciones por animal.
Pruebas microbiológicas
La identificación inicial se realizó por medio de un examen microscópico de las muestras de tejido pulmonar mediante la coloración de gram, con la finalidad de obtener un diagnóstico presuntivo hasta la obtención de los resultados de las pruebas microbiológicas [18]. Posteriormente se procedió a la siembra en medios de cultivo de Sabouraud simple y Lowëstein Jensen. Las pruebas microbiológicas y bioquímicas realizadas siguieron los procedimientos estandarizados utilizados por el Laboratorio de Investigación de Actinomicetos Patógenos Humanos y del Suelo, dirigido por el Dr. José Antonio Serrano, de la Facultad de Farmacia de la Universidad de Los Andes. Las pruebas bioquímicas consistieron en la hidrólisis de xantina, hipoxantina, tirosina y caseína y las pruebas de descomposición de urea y resistencia a la lisozima [19,20].
Pruebas moleculares
La identificación molecular se realizó en el Observatoire Français des Nocardioses (OFN) en Lyon, Francia, utilizando la técnica de PCR y secuenciación parcial del ARN ribosomal 16S. La amplificación de un fragmento de aproximadamente 600 nucleótidos se hizo utilizando los primers Noc1 (5- GCTTAACACATGCAAGTCG-3) y Noc2 (5- GAATTCCAGTCTCCCCTG-3) y bajo las condiciones de amplificación descritas por Rodríguez-Nava et al [21]. El análisis de secuencia de cada cepa se realizó comparando los resultados con los reportados en la base de datos del GenBank.
Resultados
Luego de su fallecimiento espontáneo (aproximadamente a los 7 ± 3 días de su llegada al bioterio), los ratones fueron trasladados al Departamento de Anatomía Patológica para su estudio. A la inspección, los ratones no presentaron signos físicos de enfermedad. La necropsia no mostró cambios macroscópicos en el pulmón o en otros órganos (bazo, hígado), sin embargo el estudio histopatológico reveló la presencia de infiltrados linfomonocitarios con focos de hemorragia perialveolar sólo en los pulmones de los ratones evaluados.
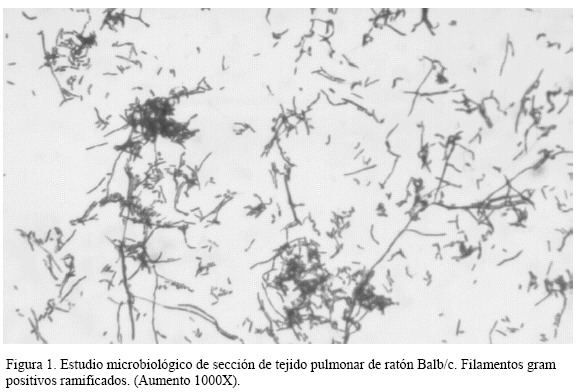
La coloración de gram de secciones de tejido pulmonar arrojó la presencia de filamentos grampositivos, ramificados, fragmentados en forma cocobacilares (Figura 1). Dicha coloración fue negativa para la presencia de estos filamentos en los otros órganos examinados (bazo e hígado). En los medios de cultivo sembrados en Sabouraud simple y Lowëstein Jensen se observó crecimiento de múltiples colonias que no degradaban xantina, pero sí degradaban hipoxantina, caseína, tirosina, urea y lisozima lo cual hizo sugerir que la cepa correspondía a la especie Nocardia brasiliensis.
Sin embargo, los resultados obtenidos por el Observatoire Français des Nocardioses en el estudio molecular de la cepa por PCR, secuenciación y análisis de secuencia, demostraron un alto grado de similitud con la cepa tipo de la especie Nocardia cyriacigeorgica DSM 44484T. De acuerdo a los parámetros de similitud (> 99%) establecidos por Rodríguez-Nava et al [21], para la identificación a nivel de especie de cepas del género Nocardia, la cepa estudiada en este trabajo fue identificada como perteneciente a la especie Nocardia cyriacigeorgica con un porcentaje de similitud del 99.8%.
Discusión
El primer caso de infección natural en animales por Nocardia se atribuye a Edmond Nocard quien en 1888 reportó por primera vez el aislamiento de un actinomiceto aerobio de una vaca con pleuroneumonía [2]. Para el conocimiento de los autores, este trabajo representa el primer reporte de una infección natural de la especie recientemente descrita, N. cyriacigeorgica en roedores, específicamente en ratones experimentales de la cepa Balb/c.
Los miembros del género Nocardia se encuentran distribuidos en forma universal habitualmente en el suelo, aire, agua salada y fresca y en materia orgánica en descomposición [1]. Estudios llevados a cabo en nuestro país han demostrado la presencia de Nocardia sp y Nocardia asteroides en suelos de los estados Amazonas, Falcón, Mérida y Lara [4,22]. Aun cuando no conocemos con precisión cuál es la fuente de infección natural de la enfermedad en estos animales de experimentación, sospechamos que la misma provenga de las camas usadas en las jaulas de los roedores, ya que las jaulas son previamente esterilizadas antes de su uso en el Bioterio. Para descartar el aire como fuente de adquisición de la Nocardia se procedió a la colocación de placas de agar abiertas al aire durante 24 horas dentro de los diferentes ambientes del Bioterio y de los sistemas de ventilación, no detectándose crecimiento de estas bacterias en las mismas. Es importante señalar que las camas de las jaulas son conchas de arroz provenientes de fincas ubicadas en el estado Portuguesa donde se ha detectado previamente la presencia de N. brasiliensis [23].
La mayoría de las infecciones por Nocardia se adquieren por inhalación [24]. El hecho de que la manifestación más frecuente de enfermedad por bacterias de este género es la nocardiosis pulmonar, apoya el concepto de la transmisión mayoritariamente aérea de estos patógenos. Por ejemplo, se ha demostrado la infección natural por adquisición inhalatoria de N. nova en Limnocorax flavirostra [17], N. asteroides en búfalos [25] y llamas [26], y N. brasiliensis en caballos [27], entre otros. La afectación exclusiva a nivel pulmonar descrita previamente apoya la vía inhalatoria como mecanismo de adquisición de la Nocardia en los animales de experimentación de este estudio.
La nocardiosis es una entidad de difícil diagnóstico debido en gran parte a su inespecificidad clínica. Generalmente depende de la demostración del organismo en muestras de tejidos o secreciones así como el aislamiento e identificación en cultivos microbiológicos [1]. Las técnicas serológicas hasta la fecha no son lo suficientemente sensibles y muestran un gran número de reacciones cruzadas con otros actinomicetos. Las características quimotaxonómicas, fundamentalmente la presencia de una abundante cantidad de ácido mesodiaminopimélico, arabinosa, galactosa y ácidos micólicos con 46 a 60 carbonos en las paredes celulares de estos microorganismos, es otra característica fundamental para la identificación de Nocardia a nivel de género [28].
El elevado número de especies recientemente descritas en la literatura, ha evidenciado la complejidad taxonómica de este género y ha incentivado la búsqueda de otros métodos para la identificación precisa de las especies, lo cual es sumamente importante para la determinación de la patogenicidad y la predicción de la susceptibilidad antimicrobiana de cada especie en particular. El desarrollo de nuevas técnicas moleculares tales como la amplificación de un fragmento del gen hsp65 por PCR y la secuenciación genómica del ADN ribosomal 16S, han permitido la identificación de nuevas especies de Nocardia. En particular, Yassin et al. describieron por primera vez el aislamiento de N. cyriacigeorgica a partir de secreciones respiratorias de un paciente con bronquitis crónica [29]. El análisis secuencial de 1.377 bp de ARNr 16S demostró un alto grado de similitud con otras especies de Nocardia, sin embargo estudios de hibridización de ADN-ADN han demostrado diferencias sustanciales con especies como N. asteroides, N. abscessus y N. paucirovans [30]. Estudios recientes de análisis secuencial del gen 16S del rRNA y del gen hsp65, así como de hibridización ADN-ADN, han permitido confirmar que N. asteroides con patrón de sensibilidad antimicrobiana Tipo VI no es más que N. cyriacigeorgica [31].
Hasta ahora, no existen reportes acerca del aislamiento de esta especie de Nocardia en animales. Recientemente, Wauters et al. reportaron el aislamiento de N. cyriacigeorgica de muestras de secreciones respiratorias, lesiones piógenas, sangre, absceso cerebral y liquido cefalorraquídeo, todas provenientes de individuos inmunocomprometidos [30]. Asimismo, se reportaron dos casos de nocardiosis sistémica por Nocardia cyriacigeorgica en pacientes inmunosuprimidos [19]. Las infecciones por Nocardia en humanos cada vez son más comunes especialmente después del advenimiento de la cirugía de trasplante y en pacientes cuya inmunidad normal ha sido afectada por terapia inmunosupresora.
En conclusión, este trabajo representa el primer reporte de una infección natural por bacterias del género Nocardia en ratones Balb/c. Asimismo, se presenta por primera vez el aislamiento, en roedores, de la especie de Nocardia cyriacigeorgica en Venezuela y a nivel mundial. Las técnicas de biología molecular cada vez juegan un papel más importante en la identificación objetiva de diversos agentes etiológicos especialmente en el orden de los Actinomicetos. Más aún, el uso de estas técnicas facilitaría la realización de estudios biológicos, epidemiológicos y edáficos para una mejor comprensión de las enfermedades producidas por las nocardias.
Conclusiones
1. La necropsia de ratones Balb/c fallecidos en el Bioterio del Decanato de Medicina de la Universidad Centroccidental Lisandro Alvarado demostró la presencia de infiltrados linfomonocitarios con focos de hemorragia perialveolar exclusivamente en los pulmones de estos roedores. No se observaron cambios macroscópicos o microscópicos en otros órganos examinados (bazo e hígado).
2. La coloracion de gram del tejido pulmonar reveló la presencia de filamentos grampositivos, ramificados y fragmentados en forma cocobacilares.
3. En los medios de cultivo sembrados en Sabouraud Simple y Lowëstein Jensen se observó crecimiento de múltiples colonias, lo que sugirió por pruebas bioquímicas convencionales la presencia de Nocardia brasiliensis.
4. La identificación molecular utilizando la técnica de PCR y secuenciación parcial del ARN ribosomal 16S permitió la identificación definitiva de N. cyriacigeorgica.
5. Los métodos moleculares permiten la detección rápida de especies de Nocardia evitando las reacciones cruzadas observadas con otros géneros taxonómicamente cercanos.
Recomendaciones
1. Realizar estudios biológicos, epidemiológicos y edáficos más extensivos para la identificación de nuevas especies del género Nocardia, haciendo uso de nuevas herramientas de biología molecular disponibles en los centros de investigación de nuestro país.
2. Considerar la nocardiosis pulmonar entre los diagnósticos diferenciales de enfermedades respiratorias en pacientes que cursan con enfermedades o terapias inmunosupresoras.
Agradecimientos
Este trabajo fue financiado por el Consejo de Desarrollo Científico y Humanístico de la Universidad Centroccidental Lisandro Alvarado (CDCHT-UCLA), Proyecto No. 012-ME-2005 y el Fondo Nacional de Ciencia, Tecnología e Investigación (FONACIT), Proyecto Ecos Nord V06S01.
Nota: Trabajo ganador del primer premio, en la modalidad de cartel, en la IV Reunión Internacional sobre Biología de Nocardia, en el IV Simposio Internacional de Micología Médica y en el IV Simposio de Micetoma celebrado en Monterrey, Nuevo León, México del 24 al 26 de Mayo del 2007.
Referencias
1. McNeil M, Brown J. The medically important aerobic actinomycetes: epidemiology and microbiology. Clin Microbiol Rev 1994; 7: 357-417. [ Links ]
2. Beaman B, Beaman L. Nocardia species: host-parasite relationships. Clin Microbiol Rev 1994; 7: 213-64. [ Links ]
3. Brown-Elliott B, Brown J, Conville P, Wallace R. Clinical and laboratory features of the Nocardia spp. based on current molecular taxonomy. Clin Microbiol Rev 2006; 19: 259-82. [ Links ]
4. Uzcátegui-Negrón M, Serrano J, García E, Díaz-Corrales F, Couble A, Casoli E, y col. Aislamiento de Nocardia asteroides de muestras de suelo de cinco estados de Venezuela. Rev Soc Ven Microbiol 2001; 21: 17-23. [ Links ]
5. Chun J, Goodfellow M. A phylogenetic analysis of the genus Nocardia with 16S rRNA gene sequences. Int J Syst Bacteriol 1995; 45: 240–5. [ Links ]
6. Conville P, Fischer S, Cartwright C, Witebsky F. Identification of Nocardia species by restriction endonuclease analysis of an amplified portion of the 16S rRNA gene. J Clin Microbiol 2000; 38: 158–64. [ Links ]
7. Pier A, Fichtner R. Distribution of serotypes of Nocardia asteroides from animal, human and environmental sources. J Clin Microbiol 1981;13(3): 548-53. [ Links ]
8. Beaman B, Sugar A. Nocardia in naturally acquired and experimental infections in animals. J Hyg 1983; 91: 393-419. [ Links ]
9. Takahashi K, Toda N, Kakiichi N, Sawada T, Sako T, Koyama H, et al. Nasal nocardiosis in a calf. J Vet Med Sci 1999; 61: 421-3. [ Links ]
10. Biberstein L, Jang S, Hirsh D. Nocardia asteroides infection in horses: a review. J Am Vet Med Assoc 1985; 186: 273-7. [ Links ]
11. Buchanan A, Beaman B, Pedersen N, Anderson M, Scott J. Nocardia asteroides recovery from a dog with steroid and antibiotic unresponsive idiopathic polyarthritis. J Clin Microbiol 1983; 18(3): 702-8. [ Links ]
12. Wunder J, Briner W, Calkins G. Identification of cultivable bacteria in dental plaque from the beagle dog. J Dent Res 1976; 55: 1097-102. [ Links ]
13. Isik K, Chun J, Hah Y, Goodfelow M. Nocardia salmonicida nom. Rev. a fish pathogen. Int J Sys Bacteriol 1999; 49: 833-7. [ Links ]
14. Wolke R, Meade T. Nocardiosis in chanook salmon. J Wildl Dis 1974;10: 149-54. [ Links ]
15. Baumgartner R, Hoop R, Widmer R. Atypical nocardiosis in a red iored Amazon Parrot (Amazonia autumnalis autumnalis). J Am Assoc Vet 1944; 8: 125-7. [ Links ]
16. Copper J. Post-mortem findings in east African birds of prey. J Wild Dis 1973; 9: 368-75. [ Links ]
17. Bacciarini L, Posthaus H, Pagan O, Miserez R. Nocardia nova causing pulmonary disease of black crakes (Limnocorax flavirostra). Vet Pathol 1999; 36: 345-7. [ Links ]
18. Berd D. Laboratory identification of clinically important aerobic actinomycetes. Appl Microbiol 1973; 25: 665–81. [ Links ]
19. Serrano J, Sandoval A. Manual de laboratorio para el estudio de los actinomicetales patógenos. Consejo de Publicaciones de la Universidad de Los Andes, Mérida, Venezuela, 1995. [ Links ]
20. Boiron P, Provost F, Dupont B. Methods de laboratoire pour le diagnostic de la Nocardiosis. Instituto Pasteur, Francia, 1993. [ Links ]
21. Rodriguez-Nava V, Coublee A, Devulder G, Flandrois J, Boiron P, Laurent F. Use of PCR restriction enzyme pattern analysis and sequencing for hsp65 gene-based identification of Nocardia species. J Clin Microbiol 2006;44:536-46. [ Links ]
22. Salfelder K, Schwarz J, Romero A, de Liscano T, Zambrano Z, Diaz I. Hábitat de Nocardia asteroides, Phialophora pedrosoi y Cryptococcus neoformans en Venezuela. Mycopathologia 1968; 34: 144-54. [ Links ]
23. Campins H. Síntesis de las investigaciones micológicas realizadas en Venezuela durante los años 1946-1956. Mycopathologia 1958; 9: 152-75. [ Links ]
24. Saubolle M, Sussland D. Nocardiosis: review of clinical and laboratory experience. J Clin Microbiol 2003; 41: 4497-501. [ Links ]
25. Pal M. Nocardia asteroides as a cause of pneumonia in a buffalo calf. Rev Sci Tech 1997; 16: 881-4. [ Links ]
26. Chang CD, Boosinger TR, Dowling PM, McRae EE, Tyler JW, Pugh DG. Nocardiosis in a llama. J Vet Diagn Invest 1993; 5: 631-4. [ Links ]
27. Deem D, Harrington D. Nocardia brasiliensis in a horse with pneumonia and pleuritis. Cornell Vet 1980; 70: 321-8. [ Links ]
28. Roth A, Andrees S, Kroppenstedt R, Harmsen D, Mauch H. Phylogeny of the genus Nocardia based on reassessed 16S rRNA gene sequences reveals underspeciation and division of strains classified as Nocardia asteroides into three established species and two unnamed taxons. J Clin Microbiol 2003; 41: 851-6. [ Links ]
29. Yassin A, Rainey F, Steinier U. Nocardia cyriacigeorgica sp. nov. Int J Syst Evol Microbiol 2001; 51: 1419-23. [ Links ]
30. Wauters G, Avesani V, Charlier J, Janssens M, Vaneechoutte M, Delmée M. Distribution of Nocardia species in clinical samples and their routine and rapid identification in the laboratory. J Clin Microbiol 2005; 43: 2624-8. [ Links ]
31. Conville P, Witebsky F. Organisms designated as Nocardia asteroides drug pattern type VI are members of the species Nocardia cyriacigeorgica. J Clin Microbiol 2007; 45: 2257-9. [ Links ]











 uBio
uBio