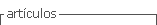Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.11 no.2 Mérida ago. 2013
Manejo de la pubertad precoz. Guías Clínicas del Servicio de Endocrinología del Instituto Autónomo Hospital Universitario De Los Andes.
Jueida Azkoul, Yanire Mejía, Marisol Meza, Yajaira Briceño, Muyela Guillen, Marieta Paoli, Grupo de Endocrinología Mérida (ENDO-MER)
Unidad de Endocrinología, Instituto Autónomo Hospital Universitario de los Andes, Mérida, Venezuela.
Dirigir correspondencia a: Jueida Azkoul; Email: jazkoul@yahoo.com
RESUMEN
La pubertad precoz (PP) se caracteriza por la aparición de caracteres sexuales secundarios antes de los 8 años en niñas y 9 años en niños, generalmente se acompaña de aceleración de la velocidad de crecimiento y de la maduración esquelética. Se clasifica en Pubertad Precoz Central (PPC) en cuyo caso existe activación completa del eje hipotálamo hipófiso gonadal (EHHG), Pubertad Precoz Periférica (PPP), aquella resultado de la exposición a esteroides sexuales, independiente de gonadotropinas, y la denominada Pubertad Precoz Combinada o Mixta, cuando la maduración del eje hipotálamo hipofisario se produce tras el estímulo de una PP de causa periférica, produciendo secundariamente una PPC. La más frecuente es la PPC, y en las niñas la etiología es idiopática en el 90% de los casos, a diferencia de los niños en quienes la causa es principalmente orgánica. En este artículo se hacen consideraciones sobre las diferentes estrategias de diagnóstico y tratamiento de la PP y se presenta el protocolo del Servicio de Endocrinología del IAHULA, Mérida, Venezuela.
Palabras clave: Pubertad precoz, análogos de GnRH.
ABSTRACT
Precocious puberty (PP) is characterized by the appearance of secondary sexual characteristics before 8 years old in girls and 9 in boys, usually accompanied by acceleration of growth velocity and skeletal maturation. The PP is classified in Central Precocious Puberty (CPP) in which case there is full activation of the hypothalamic pituitary gonadal axis (HHGA), Peripheral Precocious Puberty (PPP), that result from exposure to sex steroids, gonadotropin-independent, and Combined or Mixed Precocious Puberty, when the maturation of the hypothalamic pituitary axis occurs after a peripheral cause of PP, that secondarily produce a CPP. The most common is the CPP; the etiology in girls is idiopathic in 90% of cases, unlike boys in whom the cause is mainly organic. In this paper, considerations about the different strategies for diagnosis and treatment of PP are made, and the protocol of the Endocrinology Unit, IAHULA, Mérida, Venezuela is presented.
Key words: precocious puberty, GnRH analogues.
Artículo recibido en: Marzo 2013 . Aceptado para publicación en: Mayo 2013
La pubertad precoz (PP) se define como la aparición de caracteres sexuales secundarios a una edad no fisiológica, antes de los 8 años en niñas y 9 años en niños, que se acompaña de aceleración de la velocidad de crecimiento y adelanto de la edad ósea1-4. La PP puede afectar los dos generos y usualmente se caracteriza por aparición de desarrollo mamario en niñas y volumen testicular mayor a 4 mi en niños (Tanner estadio 2)5,6. En condiciones normales, el inicio de la pubertad se produce a una edad apropiada, debido a la actividad coordinada de las neuronas hipotalámicas y la consecuente secreción de la Hormona Liberadora de Gonadotropina (GnRH), la cual estimula la producción hipofisaria de gonadotropinas que finalmente actúan sobre la gónada para la producción de esteroides sexuales5.
En vista de que la aparición precoz de caracteres sexuales secundarios es un motivo de consulta frecuente, nuestra Unidad de Endocrinología realizó la guía que presentamos a continuación, basándonos en la revisión de las propuestas y consensos de las diferentes asociaciones internacionales, así como en los lineamientos propios de nuestra unidad, acordes a nuestras necesidades y limitaciones, con la finalidad de unificar criterios y pautas en el diagnóstico y tratamiento de esta patología.
ETIOPATOGENIA
Desde un punto de vista fisiopatológico, la PP puede clasificarse en:
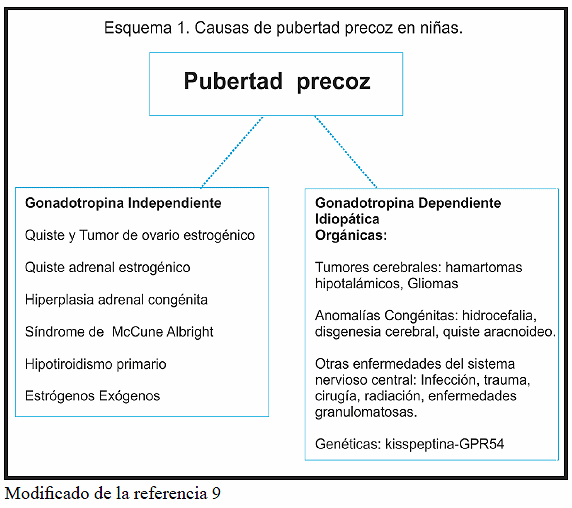
1- Pubertad Precoz Central (PPC): es aquella de pendiente de la activación completa del eje hipotálamo hipófiso gonadal (EHHG), esto es, dependiente de gonadotropinas4.
2- Pubertad Precoz Periférica (PPP): es aquella que resulta de la exposición a esteroides sexuales, sean éstos de origen gonadal o no, independiente de gonadotropinas, la cual puede ser isosexual o heterosexual4.
3- Pubertad Precoz Combinada o Mixta: se denomina así, cuando la maduración del eje hipotálamo hipofisario se produce tras el estímulo de cualquier PP de causa periférica, produciendo secundariamente una PPC7.
Existe una situación límite que se define como "pubertad adelantada o temprana" en la cual el desarrollo puberal se inicia alrededor de los ocho años en niñas y los nueve en niños. Este cuadro, aunque estrictamente no pueda considerarse patológico, puede tener repercusiones negativas en la talla final o en las consideraciones sociales si su progresión puberal es muy rápida, en cuyo caso, el manejo terapéutico es semejante a la PPC2.
Se describe que la PPC es más frecuente en niñas, con una incidencia de 1-8 casos por 10.000/año, mientras que en los varones es de 1-2 casos por 10.000/año8. En relación a su etiología, en las niñas, el 90% es idiopática a diferencia de los niños en quienes la causa es orgánica en la mayoría de los casos9. En los esquemas 1 y 2 se detallan las causas de PPC y PPP.
Existen variantes del desarrollo puberal, tales como la telarquia prematura aislada en las niñas, que se caracteriza por desarrollo mamario uni o bilateral antes de los 8 años de edad, sin evidencia de otros signos de PP (aceleración del crecimiento, edad ósea incrementada o aparición de vello púbico y/o axilar). Es una entidad relativamente frecuente, con una incidencia de hasta 21,2 casos por 100.000 niñas/año. Aparece antes de los 2 años de edad y tiende a la regresión espontánea entre los 6 meses a 6 años de edad. El segundo pico de presentación es entre los 5 y 7 años de edad, pudiendo progresar a un cuadro clínico de PPC1. Aunque su etiología es desconocida, algunos autores han planteado como causa el aumento de la sensibilidad a los estrógenos circulantes, la secreción transitoria de estrógenos por los folículos oválicos, el aumento de los estrógenos de origen suprarrenal y la activación transitoria del EHHG con aumento de la secreción de la Hormona Folículo Estimulante (FSH). Se debe pesquisar la presencia de los llamados "disruptores endocrinos" o de contaminantes ambientales como el consumo de soya, exposición a derivados de lavanda o cremas con fitoestrogenos10.
Otra variante del desarrollo puberal, es la menarquia prematura aislada, proceso de sangrado vaginal aislado o periódico en niñas con edades comprendidas entre 1 y 9 años, sin acompañarse de otros signos de desarrollo sexual secundario. Puede ser la primera manifestación de PPP la cual debe descartarse. En caso de sangrado vaginal aislado, puede ser debido a procesos tumorales vaginales o uterinos, enfermedad inflamatoria pélvica, cuerpo extraño en vagina, abuso sexual y exposición a estrógenos exógenos1,2. Finalmente, se describe la adrenarquia o pubarquia prematura aislada, como una condición autolimitada caracterizada por la aparición de vello púbico y ocasionalmente axilar con olor apocrino y/o acné antes de los 8 años en la niña y 9 años en el niño, sin otras manifestaciones propias de la pubertad. Puede coincidir con un aumento de la velocidad de crecimiento y de la edad ósea en forma transitoria, que no compromete la talla final. Es más común en niñas que en niños así como en grupos raciales afrocaribeños. Con frecuencia se debe descartar la hiperplasia adrenal congénita de manifestación tardía y, al igual que las variantes anteriores, se requiere seguimiento, más no tratamiento específico10-13.
DIAGNÓSTICO DE PUBERTAD PRECOZ
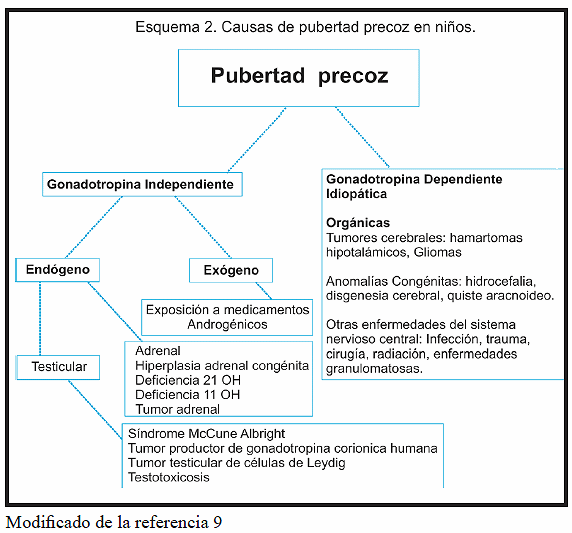
La aparición de caracteres sexuales secundarios antes de los 8 años en niñas y de los 9 años en niños junto con la aceleración de la velocidad de crecimiento debe plantear la sospecha de un cuadro clínico de pubertad precoz. Para ello, es preciso realizar una anamnesis meticulosa, junto a un examen físico detallado y solicitar posteriormente las pruebas complementarias que nos puedan orientar al diagnóstico8. La anamnesis deberá recoger antecedentes familiares incluyendo: edad de la menarquia materna y del estirón puberal en el padre, historia familiar de pubertad precoz, hirsutismo, esterilidad, facomatosis, hipotiroidismo, hiperplasia suprarrenal y ovario poliquístico. Además, antecedentes personales tales como: peso y talla al nacimiento, antecedentes patológicos (infecciones o traumatismos en sistema nervioso central, medicación hormonal y otros tratamientos recibidos)14,15. Es necesario detallar la edad de inicio y aparición cronológica de los caracteres sexuales secundarios, en vista de que la PPP es de aparición abrupta y los signos y síntomas no siguen el orden cronológico propio de la pubertad normal (el sangrado vaginal puede ser la primera manifestación clínica), a diferencia de la PPC, en donde casi siempre estas características clínicas respetan la misma secuencia de aparición de una pubertad fisiológica (telarquia, pubarquia, menarquia). Además, es importante investigar la existencia o no de aceleración de la velocidad de crecimiento y síntomas asociados a hipertensión intracraneal (cefalea, vómitos o alteraciones visuales)1. Ante cualquier paciente con sospecha de PP es preciso realizar examen físico con énfasis en las medidas antropométricas que incluyan peso, talla, velocidad de crecimiento, índice de masa corporal, ubicando a cada uno de estos en sus respectivos percentiles. Además, determinar brazada y relación de los distintos segmentos corporales, así como, la presencia de acné, olor apocrino, cabello oleoso, vello corporal, manchas café con leche, acantosis y estrías. Se debe realizar evaluación cardiovascular que incluya el registro de presión arterial y frecuencia cardiaca. Seguidamente realizar palpación de la tiroides, palpación abdominal en la búsqueda de tumores suprarrenales, hepáticos u ováricos y una adecuada exploración genital con descripción detallada del estadio puberal según Tanner (fig. 1A y 1B)1,8,15.
La maduración ósea se incluirá en la primera valoración del paciente y a intervalos de 10 a 12 meses en su seguimiento. Un avance > 2 desviaciones estándar en la edad ósea discrimina la PPC de las variantes normales, que nunca tienen más de 1 ó 1,5 desviaciones estándar de adelanto respecto a la edad cronológica. Sin embargo, al principio de su evolución, la PP puede cursar con adelanto de edad ósea menor de 2 desviaciones estándar8. El cálculo de la edad ósea se realiza mediante radiografía de mano y muñeca izquierda, usualmente por comparación utilizando el atlas de Greulich y Pyle o, en nuestro caso, el atlas venezolano. Es necesario el cálculo de la predicción de talla final mediante el método de Bayley y Pinneau, para decisiones terapéuticas futuras y el seguimiento del paciente1,8,13.
La ecografia pélvica permite evaluar las dimensiones ováricas y uterinas, la relación cuerpo-cérvix y el engrosamiento endometrial, adicionalmente, puede mostrar la presencia de masas y quistes foliculares815. Una longitud uterina >4 cm tiene una sensibilidad del 68% y una especificidad del 100% para inicio de la pubertad, aunque otros autores sitúan el punto de corte entre 3 y 3,6 cm15,16; en nuestro servicio se usa como punto de corte una longitud uterina > 3,5 cm como sugestivo de inicio puberal. La presencia de línea endometrial refleja estímulo estrogénico con una especificidad del 100% y una sensibilidad entre 42-87%3,17. Un volumen ovárico >1,5 mL tiene una sensibilidad y especificidad de 100%16 y se puede demostrar actividad oválica; usualmente los folículos tienen un diámetro <9 mm en caso de PPC y >9 mm en PPP2,18. La ecografia testicular puede detectar tumores no palpables de células de Leydig y debe ser realizado en aquellos pacientes con volumen testicular asimétrico muy acentuado o cuando se sospeche de pubertad precoz periférica6,15.
Dentro de las pruebas paraclínicas, el test de estimulación con GnRH continúa siendo en la actualidad la herramienta de mayor valor para el diagnóstico de PPC; esta prueba se basa en la capacidad de la hipófisis para responder a la estimulación con GnRH, produciendo LH y FSH. Se administra esta hormona por vía intravenosa a una dosis de 100 μg/m2sc8,14-17 ó 2,5 Hg/kg15 con determinación de LH y FSH basal, a los 30 y 60 minutos. Existe controversia sobre del punto de corte del pico de LH a partir del cual considerar la existencia de PPC; distintos trabajos han mostrado umbrales entre 3,3 y 15 U/L, esta variabilidad puede estar mediada por factores raciales, diferencias en el tamaño muestral y el método utilizado. Cambios en el punto de corte del pico de LH condicionan cambios en la sensibilidad y especificidad de la prueba; por ello, se admiten internacionalmente como puntos de corte valores que se sitúen entre 5 y 10 U/L8. En nuestro servicio utilizamos el punto de corte de LH ≥5 U/L establecido por Kim y cols en el 201119 debido a su alta sensibilidad y especificidad para el diagnóstico de PPC.
Cuando no se encuentre disponible la GnRH, es posible realizar la prueba con acetato de Leu-prolide (análogo acuoso de GnRH) cuya presentación comercial es en ampollas de 2,8 ml que proporcionan 5 mg/mL. Esta prueba consiste en administrar el análogo por vía subcutánea a dosis de 20 μg/kg (máximo 500 μg) realizando una determinación de LH y FSH, basal y a las 2 horas, considerándose positivo para PPC un valor de LH > 9,7 μ/L8. Alternativamente se puede medir LH a los 120 minutos luego de la administración de un análogo de GnRH de depósito (3,75 mg intramuscular), una concentración de LH >10 U/L por IFMA indica activación del eje hipotálamo hipofisario14,20. En los casos de PPP los valores LH y FSH posterior al estímulo con GnRH, se encuentran suprimidos ya que no hay activación del eje HHG.
Recientemente se ha descrito de manera consistente la utilidad de la Hormona Luteinizante (LH) basal por técnicas de tercera generación para el estudio de pacientes con sospecha de PPC15. Resende y cois18, en el año 2007 establecieron como puntos de corte para diagnóstico de PPC, por método de inmunoquimioluminiscencia (ICMA), concentraciones >0,2 U/L para las niñas y >0,3 U/L para los niños. En la literatura consultada los puntos de corte para LH basal varían desde >0,1 U/L a >1,05 U/L3,15,16,21,22; en nuestro servicio, en un estudio retrospectivo de 5 años se revisaron 135 historias con diagnóstico de PPC donde se obtuvo un punto de corte de LH basal > 0,7 U/L para diagnóstico23, por lo que se utiliza el punto de corte establecido por Brito y cols, LH >0.6 U/L14. Es frecuente que se use la relación LH/FSH como un indicador del desarrollo puberal; una relación <1 es característica de la infancia en tanto que una relación >1 es típica de la pubertad15.
De acuerdo a las diferentes etiologías de PP y la orientación del caso, se pueden solicitar otros exámenes hormonales tales como: 17 hidroxipro-gesterona (170HP), dehidroepiandrosterona sulfato (DHEA-S) y androstenediona para descartar una hiperplasia suprarrenal de presentación tardía1; tirotropina (TSH) y tiroxina libre (T4L) para descartar hipotiroidismo; estradiol, testoste-rona, y en varones, además, la fracción (3 de la gonadotropina coriónica humana ((β-hCG)1,6. En general se acepta que las concentraciones séricas de estradiol tienen poca sensibilidad para el diagnóstico de pubertad precoz, sin embargo, ante una concentración de estradiol >15 pg/mL se debe descartar inicio de pubertad; de igual forma, valores >100 pg/mL sugieren la presencia de quistes o tumores oválicos asociados a PPP15,17. La testosterona es de utilidad para el diagnóstico de pubertad precoz en el niño, así, valores matinales superiores de 27 ng/dL sugieren activación puberal6,8,15. De igual forma, la (β-hCG sirve para descartar tumores ya que dicha hormona estimula la producción de testosterona por las células de Leydig pero no tiene efecto sobre el ovario24.
La resonancia magnética nuclear (RNM) contrastada del SNC con énfasis en el área sellar, es una prueba obligada en los varones con pubertad precoz central y en las niñas menores de 6 años. Es poco frecuente encontrar patologías del SNC en niñas entre 7 y 8 años de edad, por tanto, se puede individualizar la necesidad de realizarla, aunque algunos autores la recomiendan siempre21. En caso de sospecha clínica y paraclínica de PPP, donde exista hiperproducción gonadal o suprarrenal de esteroides sexuales, está indicada la realización de ecografía y/o tomografia abdominal para el descarte de lesiones en estos órganos.
TRATAMIENTO
El tratamiento de la PPC debe estar encaminado a solucionar la causa que provoca la activación precoz del eje HHG e inhibir la secreción secundaria de gonadotropinas2. Los principales objetivos de la terapia están dirigidos a: interrumpir la maduración sexual (regresión o estabilización de caracteres sexuales) hasta la edad normal de inicio puberal, suprimir la aceleración de la maduración esquelética y preservar el potencial de crecimiento estatural para evitar talla baja final. Los beneficios secundarios del tratamiento incluyen prevenir el impacto emocional en los niños, aliviar la ansiedad de los padres, retardar el comienzo de la actividad sexual, prevenir embarazos, reducir el riesgo de abuso sexual y disminuir el riesgo de cáncer de mama asociado a menarquia precoz14,17.
En caso de PPC la terapia médica utilizada consiste en el empleo de análogos de GnRH. Estos fármacos producen una estimulación continua de las células gonadotropas hipofisarias, que conlleva a una desensibilización de las mismas y en consecuencia a una disminución en la secreción de LH y en menor medida de FSH8. Es claro el efecto beneficioso de los análogos de GnRH sobre la talla adulta en niñas con PPC, sin embargo, se ha demostrado que este beneficio es mayor con el inicio temprano del tratamiento (ganancia media de 9 a 10 cm en la talla final frente 4 a 5 cm con inicio tardío). Este hecho no es extrapolable a varones, ya que existen pocos datos de talla final8, pero en general, aunque se mejora el pronóstico de la misma, suele ubicarse por debajo del potencial genético25. Los criterios para el tratamiento de la PPC con análogos de GnRH incluyen: EO avanzada en más de 2 años, predicción de talla adulta inferior a 155 cm o con deterioro progresivo en más de 5 cm por debajo de su potencial genético, rápida progresión de la pubertad y una talla baja16.
Los casos de pubertad adelantada o temprana deben evaluarse individualmente para determinar el beneficio de este tratamiento. En la tabla I se detallan los diferentes análogos disponibles en el mercado.
En la actualidad se usan exclusivamente las formas de depósito para inyección intramuscular (ampolla 3,75 mg/2cc cada 28 días y ampolla de 11,25 mg/2cc cada 3 meses). La dosis media eficaz de Triptorelina es de 100 µg/kg cada 28 días2,16,25, el Leuprolide es menos potente, necesitándose dosis comprendidas entre 150-200 µg/kg cada 28 días16,25.
Debido a que las causas de PPP son independientes del eje HHG, el tratamiento con análogos de GnRH es ineficaz26. Se procederá a resolver la causa subyacente (tumores, quites, hipotiroidismo, hiperplasia adrenal, esteroides exógenos). En la tabla II se mencionan algunos de los medicamentos disponibles para el tratamiento de PPP, su mecanismo de acción, dosis y presentación.
El seguimiento requiere una valoración conjunta de los diferentes parámetros clínicos, hormonales, radiológicos y ecográficos. La efectividad del tratamiento se evalúa mediante la observación de la detención o regresión de los caracteres sexuales secundarios27, disminución de la velocidad de crecimiento a valores pre-puberales y desaceleración de la maduración esquelética. Desde el punto de vista paraclínico se recomienda la realización de la prueba de estimulación con GnRH27 a los tres meses de iniciado el análogo y posteriormente cada 6-12 meses, tomando como supresión adecuada del eje un valor de LH ≤ 2 U/L. Sin embargo, algunos autores, en vista del alto costo y la escasa disponibilidad de la ampolla de GnRH, sugieren la posibilidad de evaluar la supresión del eje mediante la determinación de LH 2 horas posterior al cumplimiento de la dosis del análogo de depósito14, utilizando el mismo punto de corte.
El estadio de Tanner y la velocidad de crecimiento deben ser evaluados cada 3 a 6 meses3. La edad ósea debe monitorizarse cada 12 meses posterior al inicio del tratamiento con análogos del GnRH y es un parámetro de ayuda para definir el fin del tratamiento15. El tratamiento se debe mantener hasta que se considere que la edad ósea, la edad cronológica, la madurez psicológica y el pronóstico de talla final son adecuados para dejar evolucionar la pubertad. La edad ósea de 12 años en las niñas y de 13 años en los varones se ha considerado un buen indicador para decidir la suspensión del tratamiento16,17,27,28.
Grupo de Trabajo Unidad de Endocrinología, Mérida (ENDO-MER).
Yajaira Zerpa, Lilia Uzcátegui, Elsy Velázquez, Isabel Benítez, Marly Vielma, Jenny Rivera, Roald Gómez-Pérez, Miguel Sánchez, Jesús Osuna, Marcos M. Lima-Martínez, Yorgi Rincón, Víctor Gil, Magda Luna, José Zerpa, Miguel Aguirre, Julio Pacheco, Yorly Guerrero, Yubriangel Reyes.
REFERENCIAS BIBLIOGRÁFICAS
1. Soriano-Guillén L, Argente J. Pubertad precoz periférica: fundamentos clínicos y diagnóstico-terapéuticos. An Pediatr (Barc) 2012; 76:229.e1-e10. [ Links ]
2. Vargas F, Fuentes MA, Lorenzo L, Marco MV, Martínez-Aedo MJ, Ruiz R. Pubertad precoz. Pro-toc Diagn Ter Pediatr, Asoc española de pediatria (AEP) 2011;1:193-204. [ Links ]
3. Carel JC, Eugster EA, Rogol A, Ghizzoni L, Palmert M. Consensus statement on the use of gonadotro-pin-releasing hormone analogs in children. Pediatrics 2009; 123:e752-e762. [ Links ]
4. Alonso G. Cinco preguntas que debe responderse el pediatra ante un niño con pubertad precoz. Pediatría Práctica de bolsillo 2009;2:1-3. [ Links ]
5. Hernández M. Pubertad precoz. Rev Mex Reprod 2011;4:3-9. [ Links ]
6. Carel JC, Léger J. Precocious Puberty. N Engl J Med 2008;358:2366-377. [ Links ]
7. Martínez J, Sanz V. Pubertad precoz y pubertad retrasada. Pediatr Integral 2007; XI: 515-530. [ Links ]
8. Soriano-Guillén L, Argente J. Pubertad precoz central: Aspectos epidemiológicos, etiológicos y diagnóstico-terapéuticos. An Pediatr (Barc) 2011;74:336.e1-e13. [ Links ]
9. Bajpai A, Menon P. Contemporary issues in precocious puberty. Indian J Endocrinol Metab 2011;15(Supp3):S172-179. [ Links ]
10. Sepúlveda C, Mericq V. Mecanismo reguladores de la pubertad normal y sus variaciones. Rev Med Clin Condes 2011; 22: 27-38. [ Links ]
11. Traggiau C, Stanhop R. Disorders of pubertal development. Best Pract Res Clin Obstre Gynaecol. 2003;17:41-56. [ Links ]
12. Licha M. Enfoque práctico de la pubarquia precoz. Rev Venez Endocrinol Metab 2006; 4: 14-21. [ Links ]
13. Castro-Feijóo L, Pombo M. Pubertad Precoz. An Pediatric Contin 2006;4:79-87. [ Links ]
14. Brito V, Latronico A, Arnhold I, Mendonça B. Update on the etiology, diagnosis and therapeutic management of sexual precocity. Arq Bras Endrocrinol Metab 2008;52:18-31. [ Links ]
15. Jaramillo C, Campuzano G, Balthazar V, Alfaro J. Pruebas dinámicas en Endocrinología Pediátrica: Pubertad Precoz Central. Med Lab 2009; 15:311-327. [ Links ]
16. Yturriaga R, Gastelu L, Lara E. Pubertad Precoz Central. En: Dieguez C, Yturriaga R. Pubertad. 2da Edición. Editorial McGraw Hill Interamericana. España; 2006:53-71. [ Links ]
17. García H, Youlton R, Burrows R, Catanni A. Consenso sobre el diagnóstico y tratamiento de la pubertad precoz central. Rev Méd Chile 2003;131:95-110. [ Links ]
18. Styne D, Grumbach M. Pubertad: Ontogenia, neuroen-docrinología, fisiología y trastornos. En: Kronenberg H, Melmed S, Polonsky K. Williams. Tratado de Endocrinología. España 2009. 11va edición. Capitulo 24. p. [ Links ]
19. Kim HK, Jung S, Yeon J, Mi E, Jae H, Jong C. Gonadotropin-releasing hormone stimulation test for precocious puberty. Korean J Lab Med 2011;31:244-249. [ Links ]
20. Brito V, Latronico A, Arnhold P. Mendonca B. A single luteinizing hormone determination 2 hours after depot leuprolide is useful for therapy monitoring of gonadotropin-dependent precocious puberty in girls. J Clin Endocrinol Metab 2004;89:4338-4342. [ Links ]
21. Molina T. Desarrollo Puberal normal. Rev Pediatr Aten Primaria 2009;11:127-142. [ Links ]
22. Pasternak Y, Friger M, Loewenthal, Haim A and Hershkovitz E. The utility of basal serum LH in prediction of central precocious puberty in girls. Eur J Endocrinol 2012; 166: 295-299. [ Links ]
23. Uzcátegui L, Briceño Y, Paoli M, Dávila D. Utilidad del valor basal de la hormona luteinizante en el diagnóstico de pubertad precoz central. Rev Venez Endocrinol Metab 2012;10: 107. [ Links ]
24. Sanchez J, Gómez E, Gallego E, Lledo G. Protocolo diagnóstico de la pubertad precoz. Medicine 2003;8:6294-6297. [ Links ]
25. Chirinos J, Briceño Y, Camacho N, Paoli M. Pubertad precoz mixta secundaria al diagnóstico tardío de hiper-plasia suprarrenal congénita. Rev Venez Endocrinol Metab 2008;6:31-35. [ Links ]
26. López-Cantin L. Pubertad Precoz Periférica. En: Dieguez C, Yturriaga R. Pubertad. 2da Edición. Editorial McGraw Hill Interamericana. España; 2006:73-84. [ Links ]
27. Vela A, Martul P, Rica I, Aguayo A. Pubertad precoz. Endocrinol Nutr 2007;54:259-264. [ Links ]
28. Rodríguez-Sánchez A, Rodríguez-Arnao J, Rodríguez-Arnao MD. Pubertad precoz. En: Pombo M, editor. Tratado de Endocrinología Pediátrica. 3ra ed. Madrid: McGraw-Hill, Interamericana; 2002. p. 719-41. [ Links ]